Segundo Principio de la Termodinámica
De Laplace
(→Temperatura termodinámica) |
(→Bombas de calor y Refrigeradores: enunciado de Clausius) |
||
| Línea 131: | Línea 131: | ||
==Bombas de calor y Refrigeradores: enunciado de Clausius== | ==Bombas de calor y Refrigeradores: enunciado de Clausius== | ||
| + | Un refrigerador es un dispositivo que extrae calor de un foco que está más frío que el ambiente (como el interior de un frigorífico, a 5ºC) y lo vierte en el ambiente (a 22ºC, por ejemplo). | ||
| + | |||
| + | Una bomba de calor opera según el mismo principio, solo que extrae el calor del ambiente y lo vierte en un foco que está a mayor temperatura (como una habitación a 22ºC, estando el exterior a 10ºC, por ejemplo) | ||
===Enunciado de Clausius=== | ===Enunciado de Clausius=== | ||
{{ac|Enunciado de Clausius}} | {{ac|Enunciado de Clausius}} | ||
Revisión de 11:58 9 may 2009
1 Introducción
2 Máquinas térmicas: enunciado de Kelvin-Planck
2.1 Máquinas térmicas
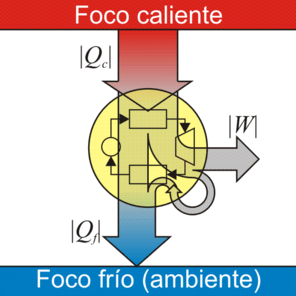
El ejemplo característico de máquina térmica es la máquina de vapor, que se emplea en la mayoría de las centrales eléctricas (sean estas térmicas, termo-solares o nucleares). En una máquina de vapor una cierta cantidad de líquido se hace hervir en un horno (foco caliente); el vapor resultante mueve una turbina, enfriándose parcialmente. El vapor enfriado pasa a un condensador, donde es enfriado a la temperatura ambiente, liberando calor y volviendo a ser líquido. Una bomba (movida por la turbina) toma ese líquido y vuelve a llevarlo al horno, manteniendo en marcha el sistema.
Tenemos cuatro términos energéticos en este proceso:
- El calor | Qc | proporcionado por el foco caliente.
- El calor | Qf | cedido al foco frío
- El trabajo | Wext | realizado por la turbina
- El trabajo Wint necesario para hacer funcionar la máquina térmica
La cantidad neta de trabajo que proporciona la máquina es lo que produce, menos lo que emplea en funcionar
De acuerdo con el primer principio de la termodinámica, por tratarse de un proceso cíclico la energía interna del sistema no cambia en un ciclo, y el trabajo neto equivale a la diferencia entre el el calor que entra y el calor que sale
Se define el rendimiento de una máquina térmica según el principio general de “lo que obtenemos dividido por lo que nos cuesta”. En este caso, “lo que obtenemos” es el trabajo neto. “Lo que nos cuesta” es el calor que entra procedente del horno. Por tanto
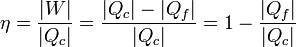
2.2 Enunciado de Kelvin-Planck
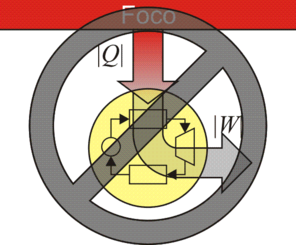
A la hora de aumentar la eficiencia de una máquina, el primer objetivo sería reducir, o eliminar si es posible, el calor de desecho | Qf | . Se plantean dos alternativas
- ¿Es posible una máquina térmica que no genere calor de desecho, sino que todo el calor absorbido se transforme en trabajo neto? Por ejemplo, podría usarse la turbina para enfriar directamente el vapor y reenviarlo al horno, sin pasar por un condensador donde se ceda calor al ambiente sin realizar trabajo útil
- ¿Es posible una reutilización del calor de desecho, de forma que se haga recircular y se incluya en el calor absorbido? La idea sería que el calor de derecho contribuya a calentar el vapor, en lugar de arrojarlo al exterior.
La respuesta a ambas preguntas es negativa.
El enunciado de Kelvin-Planck del Segundo Principio de la Termodinámica es el siguiente:Es imposible construir una máquina que, operando en un ciclo, produzca como único efecto la extracción de calor de un foco y la realización de una cantidad equivalente de trabajo
Este enunciado refleja un hecho empírico y no se deduce de ninguna ley previa.
El enunciado de Kelvin-Planck afirma que es imposible construir una máquina que tenga un rendimiento del 100%. Siempre habrá calor de desecho que, en la mayoría de los casos equivale a más de la mitad del calor absorbido.
Es importante señalar que el enunciado de Kelvin-Planck habla de procesos cíclicos, que dejan al sistema en un estado final igual al inicial. Sí es posible transformar calor en trabajo (por ejemplo, calentando un gas, que se expande como consecuencia) si el estado final es diferente del inicial.
3 Procesos reversibles e irreversibles
El Segundo principio establece a que existen procesos que pueden recorrerse en un sentido, pero no el opuesto. Podemos transformar integramente el trabajo en calor (es lo que hace una estufa de resistencias), pero no el calor en trabajo (ya que lo prohíbe el enunciado de Kelvin-Planck). Los ejemplos cotidianos abundan: si colocamos una taza de café caliente en el ambiente, el café se enfría, nunca se calienta más. Si vertemos azúcar en agua
El Segundo Principio, por tanto, permite clasificar los procesos en reversibles e irreversibles'. Un proceso reversible es aquel que puede invertirse sin producir cambio en el entorno, esto es, al final de la inversión tanto el sistema como el ambiente vuelven a su estado inicial. Si comprimimos lentamente un resorte sin fricción y posteriormente lo dejamos que se vuelva a expandir, el estado final y el inicial serían el mismo tanto para el sistema como para el entorno. Esto sería (aproximadamente) reversible.
Uno irreversible es aquel en que la restauración completa del estado inicial es imposible. Por ejemplo, si arrastramos un objeto, produciendo calor por fricción, desde una posición de A a una B, posteriormente podemos volverlo a mover de B a A, pero produciendo fricción adicional. Aunque el sistema ha vuelto a su estado inicial, el entorno no lo ha hecho (se ha disipado calor por partida doble). Éste sería un proceso irreversible.
Todos los procesos reales son irreversibles, si bien existen procesos más o menos ideales, que se acercan a la reversibilidad. Los procesos reversibles permiten establecer además criterios de máximos o mínimos para los procesos reales. Por ejemplo, el máximo rendimiento de una máquina térmica se obtiene si esta opera reversiblemente.
Existen numerosas causas de irreversibilidad, mecánicas, térmicas, químicas,… A su vez, pueden ser externas o internas.
Una irreversibilidad interna es la que se produce dentro del sistema, debido a que este no se encuentra en equilibrio. Por ejemplo, al comprimir un gas bruscamente, el has próximo al pistón posee una presión mayor que los puntos alejados (produciéndose una onda de sonido). En este momento el gas no se encuentra en equilibrio (no existe la “presión del sistema”) y evoluciona de forma irreversible.
Una irreversibilidad externa es aquella en la que quizás el sistema evoluciona reversiblemente, por ejemplo, porque su temperatura varía lentamente (como le ocurre a una taza de café caliente puesta en contacto con el exterior), pero aun así el proceso es irreversible porque la interacción con el entorno es irreversible (en el caso de la taza de café, porque existe una diferencia finita de temperaturas entre la café y el ambiente).
Así, tenemos:
- Irreversibilidad mecánica:
- Externa: Se deben a la transformación de trabajo en calor por la interacción del sistema con el entorno. El ejemplo más sencillo es la fricción. Consideremos el movimiento de ida y vuelta de un pistón en un cilindro, que roza tanto a la ida como a la vuelta. Es un proceso cíclico que transforma trabajo en calor. Su inversión significaría la transformación cíclica de calor en trabajo, lo que es imposible. Por ello, todo proceso mecánico que implique fricción (esto es, todos) es irreversible.
- Interna: Se debe a la conversión de trabajo en calor en el interior del sistema. Puede ser por fricción interna. Otro ejemplo es la expansión libre de un gas (el experimento de Joule). No hay trabajo ni intercambio de calor con el sistema, pero el proceso es irreversible.
- Irreversibilidad térmica:
- Externa: Se debe al intercambio de calor con el exterior de forma irreversible. El caso más importante es debido a una diferencia finita de temperaturas con el entorno. Su inversión implicaría que el calor debe pasar del cuerpo más frío al más caliente, lo que viola el enunciado de Clausius. Solo cuando es infinitesimal la diferencia de calor entre el sistema y su entorno puede producirse una transferencia reversible de calor.
- Interna: Debido a las transferencias de calor entre distintas partes de un mismo sistema.
- Otras irreversibilidades: Aparte de las mecánicas y térmicas tenemos irreversibilidades químicas (debidas a las reacciones espontáneas), de mezclas y disoluciones, la producción de calor por efecto Joule, etc.
Como vemos, son tantas las causas de irreversibilidad que es difícil imaginar un proceso reversible. Debe ser cuasiestático (para que el sistema esté siempre en equilibrio), sin fricción, manteniendo en todo momento la misma temperatura que el exterior, etc. Por ello los procesos reversibles son idealizaciones útiles.
4 La máquina de Carnot. Teorema de Carnot
4.1 Teorema de Carnot
Una máquina térmica reversible es aquella que en reversible en todos los pasos de su ciclo. Por ser completamente reversible, puede operar tanto en un sentido (máquina), como en el opuesto (refrigerador).
Una máquina irreversible es aquella que en todo o en parte realiza procesos irreversibles. Estas máquinas no pueden ser invertidas para que funcionen como refrigeradores.
El teorema de Carnot es un enunciado alternativo del Segundo Principio de la termodinámica, que se formula como:
El rendimiento de una máquina térmica M que opere entre dos focos no puede ser superior que el de una máquina reversible que opere entre los mismos focos
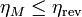
cumpliéndose la igualdad si la máquina M es también reversible y la desigualdad si es irreversible.
Aunque el teorema de Carnot es equivalente al de Kelvin-Planck, esta formulado de una forma mucho más concreta que éste. El de Kelvin-Planck nos dice que no existe la máquina perfecta con rendimiento del 100%. El teorema de Carnot nos dice además que existe un máximo para ese rendimiento y además nos dice cómo hallar ese máximo. Basta con calcular el rendimiento de una máquina reversible que actúe entre las dos temperaturas indicadas.
Máquinas reversibles puede haber muchas con diferentes soportes (solo gas, agua y vapor, materiales magnéticos,…) por lo que puede resultar sorprendente que el rendimiento de todas ellas sea el mismo si trabajan entre las mismas temperaturas.
De entre los posibles ciclos reversibles, se encuentran el de Carnot, el de Stirling o el de Ericcson. El primero de ellos es el más simple.
4.2 Ciclo de Carnot
Para conseguir la máxima eficiencia la máquina térmica reversible que necesitamos debe tomar calor de un foco caliente, cuya temperatura es como máximo Tc y verter el calor de desecho en el foco frío, situado como mínimo a una temperatura Tf.
Para que el ciclo sea óptimo, todo el calor absorbido debería tomarse a la temperatura máxima, y todo el calor de desecho, cederse a la temperatura mínima. Por ello, el ciclo que estamos buscando debe incluir dos procesos isotermos, uno de absorción de calor a Tc y uno de cesión a Tf.
Para conectar esas dos isotermas (esto es, para calentar el sistema antes de la absorción y enfriarlo antes de la cesión), debemos incluir procesos que no supongan un intercambio de calor con el exterior (ya que todo el intercambio se produce en los procesos isotermos). La forma más sencilla de conseguir esto es mediante dos procesos adiabáticos reversibles (no es la única forma, el motor de Stirling utiliza otro método, la recirculación). Por tanto, nuestra máquina térmica debe constar de cuatro pasos:
- C→D Absorción de calor Qc en un proceso isotermo a temperatura Tc.
- D→A Enfriamiento adiabático hasta la temperatura del foco frío, Tf.
- A→B Cesión de calor | Qf | al foco frío a temperatura Tf.
- B→C Calentamiento adiabático desde la temperatura del foco frío, Tf a la temperatura del foco caliente, Tc.
Aplicando este resultado al caso de un gas ideal, se llega a que el rendimiento máximo de una máquina térmica es
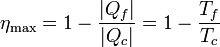
Para una máquina que trabaje entre 0°C y 100°C este rendimiento máximo es del 26.8%. ¡Muy lejos del 100% ideal!
4.3 Temperatura termodinámica
El cálculo del rendimiento de una máquina de Carnot que use gases ideales como fluido de trabajo se expresa en función de la temperatura absoluta medida con un termómetro como el de gas ideal a volumen constante. La expresión del rendimiento es por tanto dependiente de una propiedad termométrica concreta y es posible que para una máquina con un fluido de trabajo distinto el resultado fuera diferente.
Podemos evitar esta arbitrariedad empleando el propio teorema de Carnot. Si todas las máquinas reversibles poseen el mismo rendimiento, podemos medir la temperatura a partir del calor tomado o cedido por cualquiera de ellas, de acuerdo con la definición
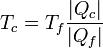
Lo único que se necesita es una temperatura de referencia, Tf, para la cual se toma la del punto triple del agua (273.16 K = 0.1°C).
Esta escala, que emplea el calor como propiedad termométrica, se denomina escala termodinámica de temperaturas. Posee la ventaja de que es fundamental, ya que se basa únicamente en leyes básicas de la física.
Por la forma en que se define la escala termodinámica resulta ser coincidente con la escala absoluta basada en un termómetro de gases ideales.
5 Bombas de calor y Refrigeradores: enunciado de Clausius
Un refrigerador es un dispositivo que extrae calor de un foco que está más frío que el ambiente (como el interior de un frigorífico, a 5ºC) y lo vierte en el ambiente (a 22ºC, por ejemplo).
Una bomba de calor opera según el mismo principio, solo que extrae el calor del ambiente y lo vierte en un foco que está a mayor temperatura (como una habitación a 22ºC, estando el exterior a 10ºC, por ejemplo)