Rendimiento de un ciclo recorrido por un gas ideal
De Laplace
Contenido |
1 Enunciado
Un gas ideal diatómico recorre el siguiente ciclo: partiendo del el estado de coordenadas, 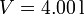 ,
,
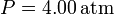 ,
, 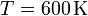 , se dilata isotérmicamente hasta duplicar su volumen.
Después se comprime a presión
constante hasta su volumen inicial. Finalmente se calienta a volumen constante hasta que alcanza la presión
original. Calcule el rendimiento del ciclo.
, se dilata isotérmicamente hasta duplicar su volumen.
Después se comprime a presión
constante hasta su volumen inicial. Finalmente se calienta a volumen constante hasta que alcanza la presión
original. Calcule el rendimiento del ciclo.
2 Diagrama
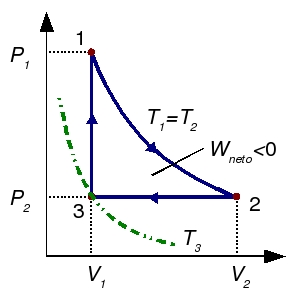
La figura muestra el ciclo en el diagrama PV. El rendimiento del ciclo es el trabajo neto obtenido dividido por el calor suministrado al gas. Vamos a calcular el trabajo y el calor absorbido en cada fase del ciclo
3 Proceso isotermo 1→2
Los datos de los estados inicial y final son
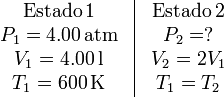
El trabajo realizado por una gas ideal en un proceso isotermo es
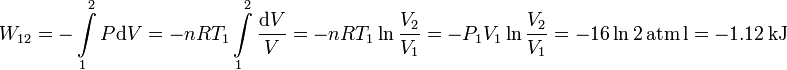
Como el proceso es isotermo, la variación de energía interna es nula. Entonces

El trabajo es negativo, lo realiza el gas sobre el entorno, y el calor es positivo, es suministrado al gas.
4 Proceso isobaro 2→3
En este caso, los datos de los procesos son
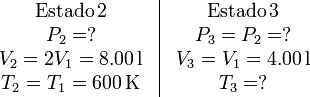
El trabajo realizado en este proceso es
W23 = − P2(V3 − V2) = − P2(V1 − V2) = P2V1
Necesitamos el valor de P2. Para ello aplicamos la ley de Boyle entre los estados 1 y 2
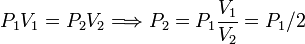
Por tanto el trabajo es
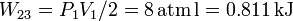
Al ser el proceso isobaro, el calor absorbido por el gas es
Q23 = ncp(T3 − T2)
El enunciado dice que el gas es diatómico. Entonces cp = 7R / 2. Para averiguar T3 relacionamos los estados 2 y 3 con la ecuación de estado del gas ideal
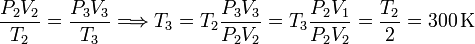
El calor es

En este caso el trabajo contribuye se realiza sobre el gas, mientras que el gas cede el calor al entorno.
5 Proceso isócoro 3→1
Aquí no hay variación de volumen, por lo que el trabajo es nulo
W31 = 0
Como el gas es diatómico, cv = 5R / 2. Entonces, el calor transferido es
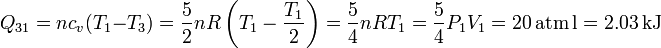
Al ser positivo, este calor es absorbido por el gas.
6 Rendimiento del ciclo
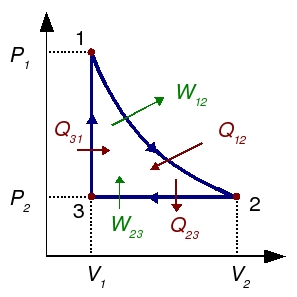
En el rendimiento debemos comparar el trabajo neto proporcionado por el gas y el calor total suministrado. De los apartados anteriores tenemos
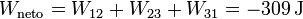
y
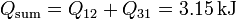
Entonces el rendimiento es
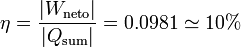
Podemos verificar que el resultado es razonable usando que, como el proceso es cíclico, la variación total de energía interna debe ser nulo, esto es, debe cumpplirse
W12 + W23 + W31 = − (Q12 + Q23 + Q31)
En el diagrama se han añadido los calores y trabajos realizados indicando cómo contribuyen a la variación de energía interna del gas.
7 Comparación con una máquina de Carnot
Podemos comparar el rendimiento obtenido en este ciclo con el que proporcionaría una máquina de Carnot trabajando entre las temperaturas extremas alcanzadas en el ciclo, T1 y T3. Tenemos
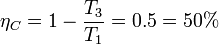
Así pues, el ciclo del enunciado proporciona un rendimiento que es el 20% del máximo que se puede alcanzar trabajando entre estas temperaturas.