Exergía de un volumen de aire comprimido en un tanque
De Laplace
1 Enunciado
Un tanque de 200 m3 de volumen contiene aire a una presión de 1 MPa y temperatura de 300 K. Determine que cantidad máxima de trabajo puede obtenerse de él si las condiciones del entorno son P0=100 kPa y T0=300 K.
2 Solución
La exergía es una propiedad que depende de las propiedades termodinámicas del sistema y del entorno. Nos dice cuál es la cantidad máxima de trabajo que podemos obtener del sistema cuando este evoluciona desde su estado inicial hasta quedar en equilibrio con el entorno (estado muerto). En este caso ese trabajo podría provenir de la expansión del gas al abrir una llave en el tanque en el que está contenido. Al expandirse podría mover un pistón o una turbina y producir así trabajo útil.
Si el sistema en su estado inicial tiene una energía interna U, un volumen V y una entropía S, y cuando llegue al equilibrio con el entorno tiene unos valores U0, V0 y S0 de esas mismas magnitudes, la exergía es
X = (U − U0) + P0(V − V0) − T0(S − S0)
siendo P0 y T0 la presión y la temperatura del entorno, respectivamente. En este problema T0 = T. Examinemos cada una de las contribuciones en nuestro caso.
- Variación de energía interna
Las temperaturas inicial y final del gas son las mismas. Considerándolo un gas ideal, su energía interna es la misma al inicio y al final del proceso, pues sólo depende de la temperatura. Así pues
U − U0 = 0
- Variación de volumen
Este término se puede escribir como
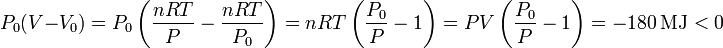
Esta contribución es negativa, es decir, es trabajo perdido. Este término representa el trabajo que debe hacer el gas para dejar sitio a su expansión contra la presión del entorno.
- Variación de entropía
Al ser un gas ideal podemos determinar su variación de entropía en función de los cambios de temperatura y presión
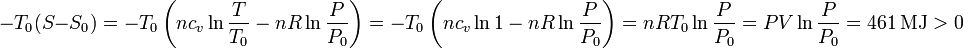
Hemos usado la ecaución de estado del gas ideal para expresar nRT0 = nRT = PV. Esta contribución es positiva. Esto se debe a que el sistema aumenta su entropía al evolucionar hasta el estado de equilibrio con el entorno.
- Valor de la exergía
Finalmente, la exergía del gas y su entorno es
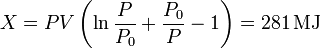
Este el trabajo que podría obtenerse si el sistema evolucionara reversiblemente hasta el estado final. Un proceso real es siempre irreversible, por lo que el trabajo real que podría obtenerse es menor que este valor.





