Fusión de hielo en un recipiente
De Laplace
Contenido |
1 Enunciado
Se tiene un bloque de masa 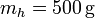 de hielo sumergido en un volumen de agua de masa
de hielo sumergido en un volumen de agua de masa 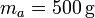 , ambos a una temperatura
, ambos a una temperatura 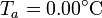 . El conjunto está contenido en un recipiente
cilíndrico de vidrio, de diámetro
. El conjunto está contenido en un recipiente
cilíndrico de vidrio, de diámetro 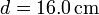 y espesor
y espesor 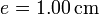 , abierto por arriba al aire (que se puede suponer un aislante térmico perfecto). El recipiente está sumergido en un baño de agua a
, abierto por arriba al aire (que se puede suponer un aislante térmico perfecto). El recipiente está sumergido en un baño de agua a 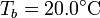 .
.
- Calcula la superficie de agua en contacto con el recipiente y la cantidad de calor que entra en él en 1.00 s.
- Halla la cantidad de hielo que se funde en el mismo tiempo. ¿Cuánto tiempo tardará en derretirse por completo?
- Calcula la variación de entropía en el sistema, en el ambiente y la variación de entropía total en la fusión completa del hielo.
- Supón que en lugar de permitir que el calor fluya directamente desde el baño al sistema se hace pasar por una máquina térmica reversible que opera entre las dos temperaturas. ¿Qué trabajo puede producirse hasta que el hielo se funde completamente? ¿Cuánto calor sale del baño en ese caso? Calcula la variación de entropía del Universo en este proceso.
Datos: Densidad de masa del agua líquida 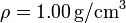 ; Conductividad térmica del vidrio
; Conductividad térmica del vidrio 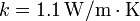 ; Entalpía específica de fusión:
; Entalpía específica de fusión: 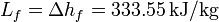
2 Flujo de calor
2.1 Altura del agua
La altura a la que llega el agua la obtenemos por simple aplicación del principio de Arquímedes. Tenemos 500 g de agua, que ocupan 500 cm³, y 500 g de hielo.
Este trozo de hielo desaloja una cantidad de agua que pesa 500 g (pues el hielo está en equilibrio y su peso se compensa por el empuje del agua). El volumen correspondiente al agua desalojada será por tanto 500 cm³ y el volumen total de agua más volumen desalojado es
A medida que el hielo se derrita, ¿el nivel de agua subirá o bajará? Ninguna de las dos cosas.
Supongamos que se ha derretido parcialmente y en un momento dado quedan 200 g de hielo. Los 300 g restantes se habrán convertido en agua, con lo que ahora tendremos 800 g de agua. Por su parte, los 200 g de hielo restante desalojan 200 g de agua, que ocupan 200 cm³, con lo que el volumen total es
Obviamente, cuando el hielo se funda por completo, tendremos 1000 g de agua que ocupan 1000 cm³.
En resumen, tal como se explicó en clase:
- El nivel del agua con hielo flotando no cambia cuando el hielo se derrite y es igual al que habría si toda el agua fuera líquida.
Si tenemos que el agua ocupa un volumen de 1000 cm³ la altura a la que llega la obtenemos dividiendo por el área
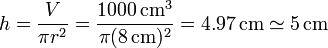
2.2 Superficie de contacto
Una vez que tenemos la altura a la que llega el área, calculamos la superficie de contacto como la suma de la base (un círculo) + más la cara lateral (un rectángulo), lo que nos da
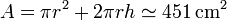
2.3 Flujo de calor
El calor entra en el sistema desde el baño por conducción:
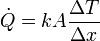
En la expresión del flujo de calor ΔT la diferencia de temperaturas entre las dos caras
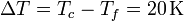
y Δx el espesor del recipiente (0.01 m). Por tanto
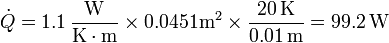
3 Fusión del hielo
3.1 Hielo fundido por segundo
La cantidad de hielo que se funde por segundo la hallamos dividiendo la cantidad de calor que entra en este tiempo por la cantidad de calor necesaria para fundir un kilogramo de hielo
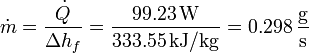
3.2 Tiempo total de fusión
A este ritmo se necesita un tiempo
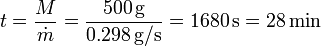
para fundir el hielo por completo. La cantidad de calor que entra en ese tiempo es
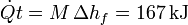
4 Variación de entropía
En este problema tenemos una variación de entropía en el agua/hielo y otra en el ambiente. Ambas ocurren a temperatura constante (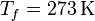 y
y 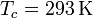 , respectivamente) y de forma reversible
, respectivamente) y de forma reversible
4.1 Variación en el agua
La variación de entropía en el agua durante el proceso completo de fusión será
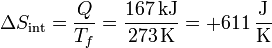
Esta variación es positiva, como corresponde a que esté aumentando el desorden en el sistema, al pasar de sólido a líquido.
4.2 Variación en el ambiente
En el ambiente tenemos una salida de calor (que va al recipiente). La variación de entropía por segundo será
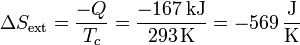
4.3 Variación neta
Sumando ambas variaciones
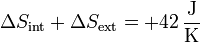
la variación es positiva, lo que quiere decir que el proceso es posible e irreversible.
El problema puede aparecer a la hora de ubicar esta producción de entropía. Si el combinado agua/hielo recibe de calor de forma reversible (pues lo hace a temperatura constante) y el baño térmico lo cede también de forma isoterma y reversible, ¿dónde está la irreversibilidad que implica este aumento de entropía?
La respuesta es el único sitio que no se ha considerado: el recipiente. Éste no es solo una frontera ideal. Es un sistema en sí mismo, que toma calor a una temperatura (293 K) y lo cede a una inferior (273 K). Así que funciona como una “máquina térmica” que no realiza trabajo alguno, sino que todo se va en producción de entropía.
5 Máquina térmica
Si el calor no llega directamente, sino a través de una máquina térmica entonces podemos aprovechar parte del calor para producir trabajo. Puesto que la condición es que el hielo se derrita por completo, el calor que llega al foco frío debe ser el mismo que antes
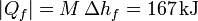
El calor que sale del foco caliente es ahora diferente (ya que una parte se emplea en trabajo). De la expresión para el rendimiento de una máquina reversible tenemos
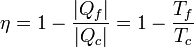

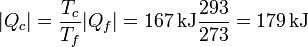
y el trabajo realizado por la máquina es
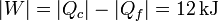
La producción de entropía es ahora nula, como corresponde a que el proceso sea completamente reversible