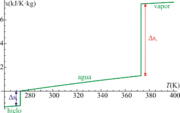
Variación de entropía en el paso de hielo a vapor
De Laplace
Contenido |
1 Enunciado
Calcule la variación de entropía de un bloque de hielo de 27.0 g a −12.0°C cuando pasa reversiblemente al estado de vapor a 115°C, a presión constante.
Datos: cp (vapor) = 2.08 kJ/kg K, cp (agua) = 4.18 kJ/kg K, cp (hielo) = 2.11 kJ/kg K, Lf = 333.55 J/g, Lv=2257 J/g
2 Desglose en procesos
Para llegar desde hielo a -12°C a vapor a 115°C, el agua debe experimentar un proceso formado por cinco tramos:
- En primer lugar hay que elevar el hielo a una temperatura de 0°C, que es a la que ocurre la fusión (suponiendo que la presión es la atmosférica).
- A continuación, hay que fundir el hielo, resultando agua a 0°C.
- Luego se calienta el agua desde 0°C hasta 100°C, en que se produce la ebullición.
- El agua se transforma en vapor de agua a 100°C.
- El vapor se calienta desde 100°C a 115°C.
Consideraremos cada uno de estos pasos por separado.
3 Calentamiento del hielo
El aumento diferencial de entropía se define como
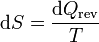
siendo dQrev la cantidad de calor que entra en el sistema en un proceso reversible.
En un calentamiento a presión constante, este calor es proporcional al aumento de temperatura
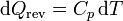
Aquí Cp es la capacidad calorífica. Si el dato es, como en este problema, el calor específico (por unidad de masa), la expresión correspondiente será
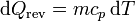
y el aumento de entropía
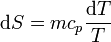
Si el calor específico es independiente de la temperatura en un rango amplio, podemos integrar esta ecuación y obtener un aumento finito de entropía
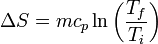
Para el caso del hielo tenemos que
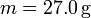
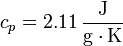
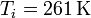
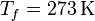
lo que nos da
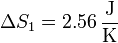
4 Fusión
La fusión del hielo ocurre a temperatura constante, por ello el aumento de la entropía es simplemente
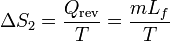
siendo
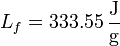
el calor de fusión (o entalpía de fusión) del hielo. La temperatura de fusión es naturalmente 273 K, por lo que el incremento de entropía es
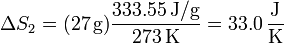
5 Calentamiento del agua
Si admitimos que el calor específico del agua no varía de 0°C a 100°C, el incremento de entropía por calentamiento del agua tiene la misma expresión que para el hielo
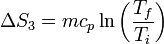
con
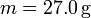
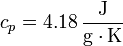
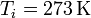
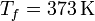
resultando
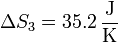
6 Ebullición
En la ebullición del agua tenemos otro proceso a temperatura constante, con un aumento de entropía
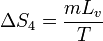
donde
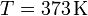 y
y 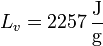
Lv es el calor de vaporización (o entalpía de vaporización) del agua. Esto nos da
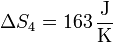
7 Calentamiento del vapor
Por último, tenemos el calentamiento del vapor, que tiene una expresión análoga a la del hielo y del agua, con
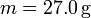
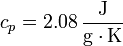
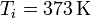
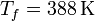
resultando
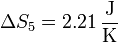
8 Aumento total de entropía
Sumando las cinco contribuciones obtenemos el aumento total de entropía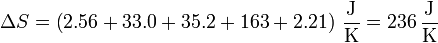
Vemos que la contribución principal, con diferencia, corresponde a la vaporización del agua. Esto está de acuerdo con la interpretación de la entropía como medida del desorden, ya que sin duda el paso que implica un mayor aumento de éste es la transformación de un líquido (con moléculas muy próximas y parcialmente ordenadas) en un gas (con moléculas alejadas y con movimientos totalmente aleatorios).