Entropía
De Laplace
Contenido |
1 Introducción
La entropía es una de las magnitudes más importantes de la termodinámica. Su definición y propiedades posee importancia en mecánica estadística, teoría de la información,… No obstante, aquí describiremos sólo su definición e interpretación en el marco de la Termodinámica clásica.
2 Desigualdad de Clausius
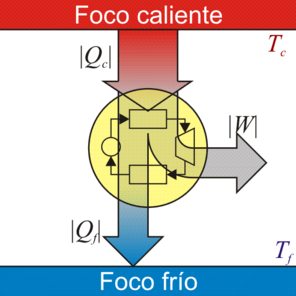
La desigualdad de Clausius establece que, para todo proceso cíclico
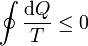
donde cada uno de los símbolos posee la siguiente interpretación
-
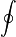
- La integral con el circulito se denomina “integral cerrada” y quiere decir que la suma se efectúa sobre una curva que se cierra sobre sí misma
- dQ
- representa la cantidad de calor diferencial que entra en el sistema desde un foco situado a la temperatura T. A lo largo de un ciclo habrá ocasiones en que su valor sea positivo y veces en que será negativo, según el sistema absorba o ceda calor.
- T
- es la temperatura del foco que cede el calor. No es la temperatura del sistema. Es más, para empezar la temperatura del sistema probablemente ni estará definida. En algunos puntos tendrá un valor y en otros será distinto. En el caso de que sí tenga un valor definido, T', este valor será menor que el exterior cuando el calor entra (ya que si no, no entraría), y será mayor que el exterior cuando el calor sale. Solo en un proceso reversible T' se diferenciará una cantidad infinitesimal de T (ya que si no, no sería reversible).
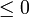
- La desigualdad de Clausius no nos dice cuanto vale la integral, en general. Solo nos informa de sus signo. Pero al hacerlo nos proporciona un criterio para clasificar los posibles procesos:
- Si la integral es negativa: el proceso es irreversible.
- Si la integral es nula: el proceso es reversible.
- Si la integral es positiva: el proceso es imposible.
3 Definición de entropía
3.1 Variación de entropía
Para un ciclo reversible, la desigualdad de Clausius se transforma en una igualdad.
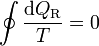 (ciclo reversible)
(ciclo reversible)Consideremos ahora un ciclo reversible que pasa por dos estados A y B. Podemos suponer este ciclo como formado por dos caminos C y C' que van de A a B, siendo uno de ellos (C') recorrido de B a A. Para este ciclo la igualdad se convierte en
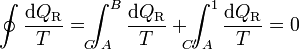
y, despejando
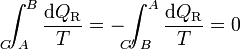
Ahora bien, por ser los caminos reversibles, la integral de B a A por C' es igual a la integral de A a B por el mismo camino C', cambiada de signo. Físicamente, esto quiere decir que si vamos de B a A por C' y en un cierto paso entra en el sistema una cantidad de calor dQR, si recorremos el camino en sentido contrario, cuando lleguemos al mismo sitio la misma cantidad de calor saldrá del sistema (es decir, que en el camino inverso entra − dQR). Por tanto
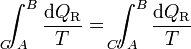
Puesto que este resultado puede extenderse a cualquier otro camino reversible que conecte A con B, concluimos que el valor de la integral es independiente del camino y por tanto solo depende de los estados inicial y final. Por ello, su valor es igual a la diferencia de una cierta función de estado que denominamos entropía
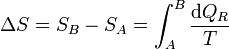
o, en forma diferencial
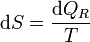
Dicho con palabras: el incremento diferencial de entropía entre dos estados vecinos es igual la cantidad de calor que entra reversiblemente entre dichos estados dividida por la temperatura a la que se intercambia el calor. Puesto que estamos hablando de procesos reversibles no es necesario distinguir entre la temperatura del ambiente T y la del sistema T', ya que en un proceso reversible ambas deben diferenciarse como mucho en una cantidad infinitesimal.
La entropía cumple que:
- Sus unidades en el sistema internacional son el J/K.
- Es una propiedad extensiva, proporcional a la cantidad de masa. Puede definirse la entropía específica, s por unidad de masa, por mol o por unidad de volumen. En cualquiera de estos casos, s es una propiedad intensiva.
3.2 Entropía absoluta
La definición anterior sólo nos da la diferencia de entropía entre dos estados, no su valor absoluto. Es más, hemos afirmado, sin probarlo, que el resultado de la integral es una diferencia de los valores de la entropía en B y en A. ¿Por qué la diferencia y no, por ejemplo, el cociente f(B) / f(A)?
Podemos definir la entropía respecto a un cierto estado de referencia, O, como la integral
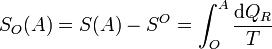
Este estado O, por definición, tendrá entropía nula respecto a sí mismo (SO(O) = 0). Puesto que O es un estado fijo, esta integral solo depende de A.
Consideremos ahora la integral entre A y B
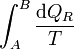
Puesto que podemos elegir el camino que queramos para ir de A a B, tomamos uno que pase por O. Entonces
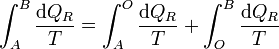
y puesto que los caminos son reversibles
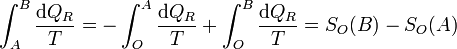
Luego efectivamente sí resulta la diferencia entre la función evaluada en B y la misma función evaluada en A.
Realmente esta definición lo que nos da es de nuevo una diferencia, pero respecto a un estado estándar, que puede ser establecido por convenio. La IUPAC recomienda definir el estado estándar como el correspondiente a una presión de 100 kPa (0.9869 atm) y 0°C (aunque la mayoría de las tablas dan la entropía del estado estandar a 25°C).
El cambio de estado de referencia lo que añade es una constante a la entropía. Por ello, si lo que queremos calcular es la variación de entropía entre dos estados A y B, nos es indiferente el estado de referencia que tomemos, nos basta con hacer la integral directamente por un camino reversible que vaya de A a B.
Cuando se formula el Tercer Principio de la termodinámica, que establece que la entropía de un cristal perfecto, a 0 K es nula, se da un verdadero valor absoluto a la entropía, pues fija un estado de referencia universal.
4 Ecuaciones de Gibbs
4.1 Para la energía interna
Al ser la entropía una función de estado, es posible usarla como variable para describir el estado del sistema, del mismo modo que se hace con la presión temperatura y volumen.
Tenemos que, sustituyendo el Primer Principio en la definición de la entropía
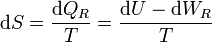
Para un sistema PVT, el trabajo reversible es
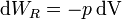

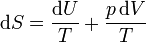
Despejando
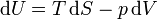
Esta es la primera ecuación de Gibbs o primera ecuación combinada del primer y segundo principios. Aunque se obtiene aplicando la expresión del trabajo y el calor en procesos reversibles, en realidad vale en cualquier circunstancia, pues solo implica funciones de estado.
4.2 Diagramas T-S
La simetría entre el par (T,S) y el par (p,V) en la primera ecuación de Gibbs sugiere que, del mismo modo que los procesos, en particular los ciclos, se representan en un diagrama pV, también pueden trazarse en un diagrama TS, en el cual el eje de abscisas lo da la entropía del sistema y el eje de ordenadas la temperatura.
En este diagrama es especialmente sencilla la representación del ciclo de Carnot.En un diagrama TS, los procesos isotermos son simplemente rectas horizontales. Los procesos adiabáticos que, por ser reversibles, son a entropía constante, son rectas verticales. Esto quiere decir que a un ciclo de Carnot le corresponde simplemente un rectángulo, independientemente de que el ciclo sea producido actuando sobre un gas ideal o sobre cualquier otro sistema.
En este diagrama el calor absorbido Qc es el área del rectángulo delimitado por el lado superior del ciclo y el eje de abscisas, mientras que el calor cedido | Qf | es el área del rectángulo definido por el lado inferior del ciclo y el eje de abscisas. El calor neto, | Qc | − | Qf | , que entra en el sistema es el área del rectángulo delimitado por el ciclo. Por el Primer Principio, este área equivale al trabajo neto efectuado por el sistema, | W | .
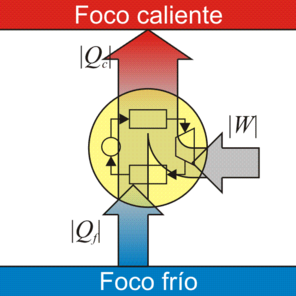
Si en vez de una máquina de Carnot tenemos un refrigerador de Carnot, la figura es exactamente la misma, solo que se recorren en sentido opuesto.
4.3 Para la entalpía
La entalpía de un sistema se define como
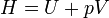
y la variación de entalpía vale
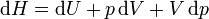
Llevando esto a la primera ecuación de Gibbs obtenemos la segunda ecuación de Gibbs:
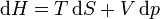
que también es cierta en cualquier proceso, reversible o irreversible.
5 Principio del aumento de entropía
5.1 Ciclo parcialmente irreversible
Supongamos ahora un ciclo irreversible formado por un camino irreversible que lleva del estado A al B y vuelve por un camino reversible. En este caso tenemos la desigualdad
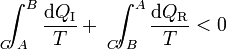
Cambiando uno de los términos de miembro
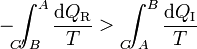
A la integral sobre el camino reversible podemos invertirla y cambiarle el signo (cosa que no podemos con el irreversible, precisamente por ser irreversible). Por tanto la desigualdad anterior equivale a decir que la integral por el camino reversible es mayor que por el irreversible
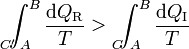
Pero la integral por el camino reversible es justamente la diferencia entre la entropía inicial y la final. Por tanto
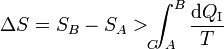
Combinando este resultado con el del caso reversible obtenemos la relación general
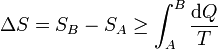
La variación de la entropía es siempre mayor o igual que la integral del calor que entra en el sistema dividido por la temperatura a la que entra. La igualdad se dará en un proceso reversible y la desigualdad en uno irreversible.
5.2 Principio del aumento de entropía
En el caso particular de un sistema aislado, ningún calor entra o sale del sistema, dQ = 0 y por tanto
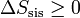 (sistema aislado)
(sistema aislado)esto es, para un sistema aislado la entropía es una función creciente en todo proceso real. Sólo si el proceso es reversible la entropía permanece constante.
Si consideramos el “universo” como el conjunto del sistema más la parte del ambiente con la que intercambia calor o trabajo, podemos tratar al universo como un sistema aislado, con lo que obtenemos el principio del aumento de entropía:
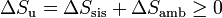
esto es, en todo proceso real la entropía aumenta (si el proceso es irreversible) o permanece estacionaria (si es reversible), pero nunca disminuye. El criterio general es

Obsérvese que en un proceso real es posible que la entropía del sistema disminuya (es lo que ocurre normalmente si se enfría), pero esa disminución debe ser compensada por un aumento en el ambiente, que supere con creces dicha disminución.
6 Producción de entropía
La desigualdad de Clausius en términos de la entropía
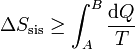
puede convertirse en una igualdad introduciendo un nuevo término
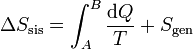
donde Sgen es la producción de entropía. Representa la cantidad de entropía producida en el sistema como consecuencia de las irreversibilidades internas. La desigualdad de Clausius establece, por tanto, el criterio

Escrita la desigualdad de esta forma podemos entender la variación de entropía como suma de dos términos: lo que entra por las paredes debido al calor intercambiado con el ambiente más lo que se produce en el propio sistema.
Otra forma de interpretarlo es escribiendo la igualdad anterior como
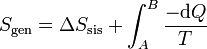
Como se ve más abajo, la variación de entropía de un foco es Q / T, siendo Q el calor que entra en el foco. En la integral anterior − dQ es la cantidad de calor que sale del sistema y por tanto entra en el foco a temperatura T. Al sumar para todos los focos estamos calculando la variación total de entropía del ambiente, Nos queda entonces
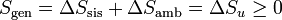
con lo que la entropía generada en el sistema y la variación de entropía del universo son cantidades equivalentes.
7 Variación de entropía en una máquina térmica
7.1 Variación de entropía de un foco térmico
En el caso particular de un foco térmico su capacidad calorífica es tan grande que la entrada o salida en él no produce un aumento o disminución de su temperatura. Esto quiere decir que el intercambio de calor con un foco es siempre un proceso reversible (desde el punto de vista del foco), por lo que la variación de entropía del foco es simplemente
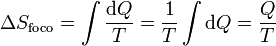
Aquí Q es el calor que entra en el foco (que normalmente saldrá del sistema).
7.2 Variación en un ciclo de la máquina
Cuando tenemos una máquina térmica que intercambia calor con dos focos a temperatura Tc y Tf, la variación de entropía del universo será la suma de la de la máquina más la del ambiente.
7.2.1 Del sistema
La máquina realiza un proceso cíclico. Puesto que la entropía es una función de estado su valor al final del ciclo será el mismo que al principio. Por tanto
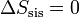 (proceso cíclico)
(proceso cíclico)7.2.2 Del ambiente
La máquina intercambia calor con dos focos térmicos. Del foco a Tc sale una cantidad de calor | Qc | . En el foco a Tf entra un calor | Qf | . Por tanto la variación de entropía del ambiente es
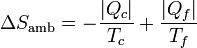
7.2.3 Del universo
Puesto que la entropía del sistema no cambia en un ciclo, la variación de entropía del universo coincide con la del ambiente
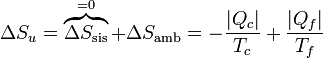
Para que esta máquina pueda operar, esta variación de entropía debe ser positiva. La reducción de entropía del primer foco debe ser compensada con creces por el aumento en el otro. Este criterio limita la eficiencia de máquinas térmicas y refrigeradores.
7.2.4 Relación con otros enunciados
A partir de este principio es inmediato llegar al enunciado de Kelvin-Planck y al de Clausius.
- Enunciado de Kelvin-Planck
- Si existiera una máquina que convierte todo el calor en trabajo, esa máquina estaría reduciendo la entropía del foco, sin aumentar la de ningún otro sitio, lo que implicaría una disminución neta de la entropía. El proceso es por tanto imposible.
- Enunciado de Clausius
- Si hubiera un refrigerador ideal que no requiriera trabajo, la misma cantidad de calor saldría del foco frío y entraría en el caliente, pero dada su menor temperatura, la disminución de entropía del foco frío seria mayor que el aumento de la del caliente, produciendo uan disminución neta de la entropía del universo. Este proceso es por tanto también imposible.
8 Entropía y trabajo perdido
8.1 Caso de una máquina térmica
Si tenemos una máquina que toma un calor | Qc | de un foco caliente a temperatura Tc y entrega un calor | Qf | a uno a Tf, el Pirmer Pincipio de la termodinámica nos dice que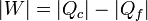
Por lo lado, la producción de entropía, según acabamos de ver es
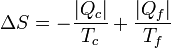
De aquí podemos despejar el calor entregado al foco frío
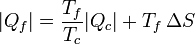
Esta ecuación nos dice que
- Existe siempre un calor entregado al foco frío, esto es, se verifica el enunciado de Kelvin-Planck.
- Para una cantidad fija que se toma del foco caliente, si se genera entropía, es decir, si la máquina es irreversible, la cantidad de calor de desecho es mayor que si no se generara. Dicho en otras palabras, se desperdicia más energía, pues una vez que va a parar al foco frío (normalmente el ambiente que nos rodea) ya no es útil para producir trabajo adicional.
Sustituyendo este calor en la expresión del trabajo obtenemos la relación
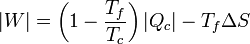
La cantidad entre paréntesis es el rendimiento de una máquina reversible que opere entre las temperaturas Tc y Tc. Por ello, esta ecuación se puede escribir
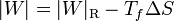
que nos dice que una máquina irreversible produce menos trabajo que una reversible, porque una parte del calor se desperdicia de forma irrecuperable. Este trabajo perdido es proporcional a la entropía creada
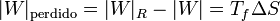
Cuanto más entropía estemos generando, más trabajo potencial se pierde y menos produce la máquina.
En términos del rendimiento, podemos escribir la ecuación anterior como
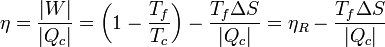
lo que nos expresa el teorema de Carnot: el máximo rendimiento lo obtenemos con una máquina reversible, y a partir de ahí empezamos a perder eficiencia, proporcionalmente a la entropía generada (para una entrada de calor siempre la misma).
También pueden expresarse estos resultados en términos del trabajo que queremos obtener de la máquina
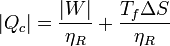
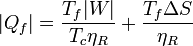
que nos dice que, si queremos obtener un trabajo dado, cuanto más irreversible sea la máquina más calor necesitamos tomar del foco caliente y más calor de desecho arrojamos al foco frío.
8.2 Caso de un refrigerador
El caso de un refrigerador es parecido al de una máquina, salvo algunos signos en la demostración. Las conclusiones son también similares.Un refrigerador extrae un cierto calor | Qf | a una temperatura Tf, para lo cual necesita realizar una cierta cantidad de trabajo | W | . El refrigerador entrega una cantidad de calor de desecho | Qc | a un foco caliente (normalmente el ambiente) a temperatura Tc. Una bomba de calor es exactamente lo mismo, salvo que el ambiente es el foco frío y lo que interesa es el calor que entrega al foco caliente. El Primer Pincipio de la termodinámica nos dice que
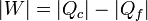
Por lo lado, la producción de entropía corresponde a que extraemos | Qf | del foco frío y entregamos | Qc | al caliente:
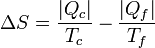
Despejando el calor entregado al foco caliente
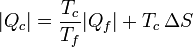
Esta ecuación nos dice que para una cantidad fija que se extrae del foco frío,la generación de entropía por el refrigerador incrementa la cantidad de calor de desecho. Dicho en otras palabras, se desperdicia más energía, pues una vez que va a parar al ambiente que nos rodea) ya no es útil para producir trabajo adicional.
Sustituyendo en la expresión del trabajo
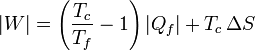
La cantidad entre paréntesis es la inversa del coeficiente de desempeño de un refrigerador reversible que opere entre las temperaturas Tc y Tc. Por ello, esta ecuación se puede escribir
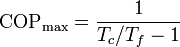

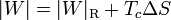
que nos dice que un refrigerador irreversible requiere más trabajo para extraer la misma cantidad de calor y que ese trabajo extra se desperdicia como calor de desecho. El trabajo extra es proporcional a la entropía creada
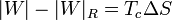
En términos del coeficiente de desempeño, podemos escribir la ecuación anterior como
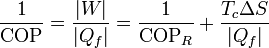
lo que nos expresa el teorema de Carnot para refrigeradores: el máximo coeficiente de desempeño lo alcanzamos con un refrigerador reversible, y a partir de ahí empezamos a perder eficiencia, más cuanto más entropía se produzca (para un calor extraído constante).
También pueden expresarse estos resultados en función del trabajo necesario
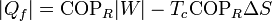
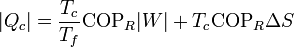
que nos dice que, para un trabajo dado, cuanto más irreversible sea el refrigerador menos calor extraemos del foco caliente y más calor de desecho arrojamos al foco caliente.
- Problemas relacionados:
9 Ejemplos
9.1 Cambio de fase
Un cambio de fase es un proceso aproximadamente isotermo, por lo que la variación de la entropía de una sustancia cuando experimenta un cambio de fase es simplemente
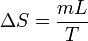
siendo L la entalpía por unidad de masa del cambio de fase (de fusión o de vaporización, por ejemplo, para el agua).
Así, en el paso de hielo sólido a agua a 1 atm se produce un aumento de entropía por unidad de masa (s = S / m):
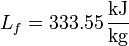

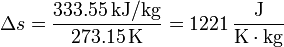
y en el paso de agua a vapor de agua a 1 atm
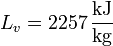

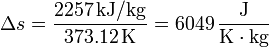
Vemos que es mucho mayor el aumento en la ebullición que en la fusión. Esto está asociado con el gran aumento del desorden al pasar de líquido a gas.
9.2 Calentamiento de una sustancia pura
Cuando se tiene una sustancia pura, como el agua, que experimenta una variación de su temperatura, siendo la presión inicial y la final la misma, la variación de la entropía de la sustancia es, según la definición
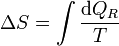
Como proceso reversible podemos imaginar uno en el que la temperatura de la sustancia va variando gradualmente por igual en todos sus puntos, siendo la presión siempre la misma. En este caso
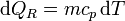
y la variación de entropía es
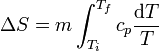
El calor específico es, en general, una función de la temperatura y debe ser tenido en cuenta a la hora de integrar. No obstante, si el rango de variación de la temperatura es pequeño, usualmente se puede aproximar cp por una constante, su valor medio, y obtener la expresión
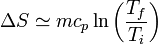
Combinado este resultado con el anterior, podemos trazar la gráfica de la entropía por unidad de masa, como función de la temperatura, para el agua desde el estado de hielo al de vapor, tomando como referencia el punto de fusión:

- Problemas relacionados:
9.3 Inmersión en un baño térmico
Un caso frecuente de cálculo de entropía es aquel en que se tiene una sustancia pura, a una temperatura T1 y se sumerge en un baño a temperatura T2, manteniéndose constante la presión. La sustancia se enfría (o se calienta, según el caso) hasta adaptarse a la temperatura del baño.
La variación de la entropía de la sustancia (si el calor específico se supone constante) es, según el apartado anterior
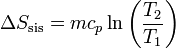
La entropía del baño también cambia, pues absorbe calor a una temperatura constante. La cantidad de calor que se intercambia con el ambiente es
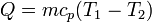
Este calor sale del sistema y entra en el ambiente, por lo que la variación de entropía del baño es
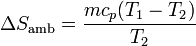
y la variación total de la entropía del universo será
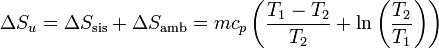
Puede probarse de foma sencilla que, tanto si T1 > T2 como si T1 < T2, esta variación es siempre positiva, esto es, el sistema siempre adquiere la temperatura del baño.
- Problema relacionado: Comparación de dos variaciones de entropía
9.4 Gas ideal
Para un gas ideal podemos obtener una expresión válida para una presión y temperatura arbitrarias.
9.4.1 Expresión en función de T y V
Para un gas ideal puro, podemos calcular el incremento diferencial de entropía a partir de la definición
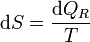
A su vez, el diferencial de calor reversible puede hallarse mediante el primer principio de la termodinámica
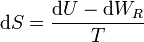
Para un gas ideal sabemos que
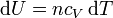
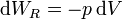

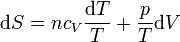
Sustituyendo la ecuación de estado del gas ideal pV = nRT queda
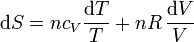
Si suponemos que la capacidad calorífica molar es independiente de la temperatura, podemos integrar esta ecuación para hallar el incremento entre dos estados
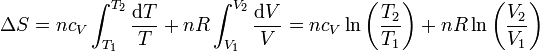
9.4.2 Expresión en función de T y p
Si lo que tenemos es el cambio en la presión, en lugar del volumen, podemos hacer un cálculo análogo empleando la entalpía
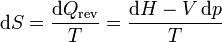
La entalpía se relaciona con la temperatura a través de la capacidad calorífica a presión constante
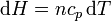
lo que lleva a la expresión para el incremento de entropía
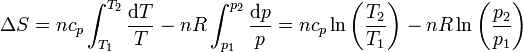
También se puede llegar a este resultado sustituyendo en la expresión de la entropía como función de T y V, el volumen como función de p y T, mediante la ecuación de los gases ideales. Tenemos que
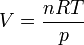
Sustituyendo en la expresión del apartado anterior
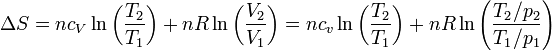
Desarrollando el logaritmo
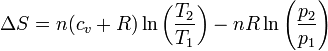
y aplicando la ley de Mayer
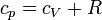

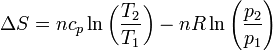
Como en el apartado anterior, este resultado se ha obtenido suponiendo que la capacidad calorífica no depende de la temperatura. Para variaciones grandes de ésta, es un efecto que se debe tener en cuenta y el resultado es más complicado.
Si uno de los dos estados es el estándar la entropía en cualesquiera otras condiciones será
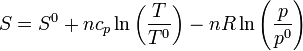
9.4.3 En función de p y V
En la expresión anterior podemos sustituir la temperatura y obtener
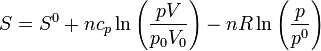
y, aplicando las propiedades de los logaritmos
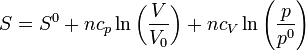
Despejando, dividiendo por ncV y hallando la exponencial:
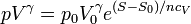
con γ = cp / cV. Un proceso adiabático reversible es siempre isentrópico por lo que pVγ es una constante en esta clase de procesos, como establece la ley de Poisson. Ahora además sabemos cuánto vale dicha constante.
9.5 Mezcla de gases
Supongamos que tenemos nk moles de N gases, todos a la misma temperatura T0 y presión p0, separados por tabiques. Si se retiran los tabiques y los gases se mezclan, se producirá un aumento de entropía, por tratarse de un proceso irreversible.
Si suponemos que los gases son ideales e inertes (esto es, que no reaccionan ni se ven afectados por el hecho de mezclarse), la entropía será la suma de las entropías individuales, como corresponde a una propiedad extensiva
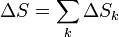
A su vez, los incrementos de la entropía para cada gas serán
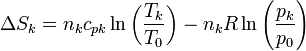
Al mezclarse los gases la temperatura de cada gas es la misma antes y después de la mezcla. En cuanto a la presión, la presión final de la mezcla es la misma que la de cada gas al principio. Sin embargo, la presión final de cada gas no es la misma, sino que se reduce a la presión parcial
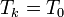
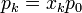
ya que, por ser inertes, la variación de la entropía se calcula como si el resto de los gases no estuviera presente. Por tanto, para cada gas, es como si pasara de ocupar un espacio pequeño a uno más grande. Aquí xk es la fracción molar
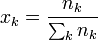
Por tanto, la variación de la entropía para cada gas es
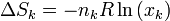
y la variación total
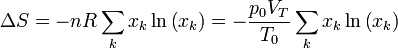
Esta variación es positiva, como corresponde a un proceso irreversible.
Supongamos, por ejemplo que la mezcla es de oxígeno y nitrógeno, ambos en la misma cantidad
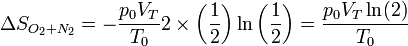
El resultado anterior es independiente de qué gases sean los que se mezclan, pero, ¿qué ocurre si mezclamos oxígeno con más oxígeno? La fórmula seguiría siendo la misma. Sin embargo, si se tienen dos volúmenes del mismo gas a la misma presión y temperatura y se elimina la separación entre ellos, la situación antes de la mezcla y después, es exactamente la misma y por tanto el aumento de entropía es nulo. Hay aquí una discontinuidad que parece depender de que uno sepa qué está mezclando. Esta es la conocida como paradoja de Gibbs y su solución no es trivial.
- Problema relacionado: Entropía de una mezcla de gases
9.6 Reacciones químicas
Cuando se analiza una reacción química lo que se suele hacer es
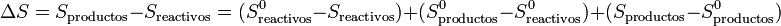
siendo S0 las entropías medidas y tabuladas en el estado estándar (normalmente a 100 kPa y 298 K). La segunda diferencia representa la variación de la entropía en la reacción en el estado estándar
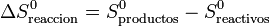
Lo que quiere decir esta descomposición en tres sumas es que, para estudiar una reacción a una cierta presión y temperatura, aprovechamos el que la entropía es una función de estado. En lugar de calcular la diferencia directamente a dicha p y T, lo que hacemos es imaginarnos que llevamos los reactivos, sin reaccionar, al estado estándar. Luego analizamos la reacción en el estado estándar, aprovechando los valores tabulados. Por último llevamos los productos a las condiciones originales.