Problemas del primer principio de la termodinámica (GIE)
De Laplace
1 Problemas de boletín
1.1 Trabajo en una compresión por un peso
Un tubo vertical de sección cuadrada de 4.0 cm de lado contiene hidrógeno a 27°C y 100 kPa de presión, que también es la temperatura y presión exterior. La tapa del cilindro puede deslizarse sin rozamiento e inicialmente se encuentra a 10.0 cm de altura.
- Suponiendo que las paredes del tubo son diatermas, calcule el trabajo realizado sobre el sistema entre el estado inicial y el estado de equilibrio final sí…
- Se coloca bruscamente sobre la tapa una pesa de 4.0 kg.
- Se colocan sobre el émbolo 4.0 kg de arena grano a grano.
- Para los dos casos anteriores, halle la variación en la energía interna del gas y el calor que entra en el sistema durante el proceso.
- Suponga ahora que las paredes del tubo son adiabáticas. ¿Cómo quedan en ese caso el trabajo, el calor y la variación de la energía interna para los dos procesos considerados?
1.2 Sucesión de tres procesos cuasiestáticos
Un cilindro de 100 cm² de sección contiene aire y está cerrado por un émbolo. Inicialmente el aire tiene una temperatura de 27 °C y una presión de 100 kPa, que también es la presión exterior, estando el émbolo a 10 cm del fondo. Entonces se realiza el siguiente proceso cuasiestático
- I: Se atornilla el émbolo y se calienta el aire hasta 327 °C, sumergiéndolo en un baño a esta temperatura.
- II: Se libera el émbolo lentamente, dejando que se expanda el aire hasta que su presión vuelve a ser la inicial. En este proceso el aire se mantiene a la temperatura de 327 °C.
- III: Con el émbolo libre, se enfría gradualmente hasta que la temperatura vuelve a ser la inicial.
Para este proceso:
- Halle la presión, volumen y temperatura al final de cada fase del proceso.
- Calcule el trabajo en cada fase, así como el trabajo neto total.
- Calcule la variación en la energía interna y el calor en cada paso y su variación neta.
1.3 Mezcla de dos cantidades de agua
En un recipiente adiabático se ponen en contacto 750 cm³ de agua a 20°C con 250 cm³ de agua a 80°C, siendo la temperatura exterior de 50°C. ¿Cuál es la temperatura final de la mezcla? ¿Cuánto calor entra en cada subsistema?
¿Cómo cambian los resultados si las paredes son diatermas?
1.4 Mezcla de agua y hielo
Dentro de un recipiente adiabático se sumerge un bloque de 100 g de hielo a 0.0 °C en 1.0 litros de agua a 20 °C. Determine si se funde todo el hielo y la temperatura final del sistema. ¿Qué ocurre si en lugar de 100 g se tiene 1.0 kg de hielo?
1.5 Mezcla de hielo y vapor de agua
En un recipiente con paredes adiabáticas y un émbolo móvil de forma que la presión es constante de 101.3 kPa, se ponen en contacto 1.0 m³ de vapor de agua a 115 °C con 500 g de hielo a −10 °C. Determine la temperatura final del sistema.
Dato: La constante específica de los gases ideales para el vapor de agua vale 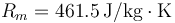
1.6 Calentamiento de agua con una resistencia
En una cámara con un émbolo móvil se coloca 500 cm³ de agua a 300 K. El exterior se encuentra a una presión de 100 kPa. Se le comunica lentamente calor al agua hasta que se evapora por completo.
- Calcule el calor necesario para que se realice este proceso.
- Halle el trabajo que se realiza sobre el agua.
- Calcule la variación en la entalpía y en la energía interna del agua.
- Suponga que el calentamiento se produce mediante una resistencia eléctrica a una tensión de 220 V por la que pasa una corriente de 2 A. ¿Cuánto tiempo tarda en realizarse el proceso? En este caso, la energía entra en el sistema en forma de calor o de trabajo?
1.7 Compresión lineal de un gas
Se tiene un volumen V0 de un gas ideal diatómico a una presión p0 y una temperatura T0 encerrado en un recipiente con un pistón móvil. Este gas se comprime reversiblemente según la ley
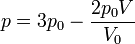
reduciéndose el volumen hasta V0 / 2.
- Trace la gráfica del proceso en un diagrama pV.
- Calcule la temperatura final del proceso.
- Calcule el trabajo neto realizado sobre el gas, la variación de su energía interna y el calor que entra en el gas durante el proceso.
- ¿Para qué volumen durante el proceso la temperatura es máxima? Halle el valor de esta temperatura máxima.
- Separando el proceso en dos: uno hasta que alcanza la temperatura máxima y otro de ahí hasta el final, halle W, ΔU y Q en cada uno de los dos subprocesos.
1.8 Expansión lineal de un gas
Se tiene una cantidad fija de un gas ideal diatómico situada a una presión p0, volumen V0 y temperatura T0. Experimenta un proceso tal que la presión final es 2p0 y el volumen 2V0.
- En este proceso, ¿cómo varía la temperatura?
- Halle el incremento de la energía interna en este proceso
Supongamos que el proceso anterior ocurre de manera cuasiestática según la ley
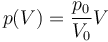
- ¿Cuánto trabajo se realiza sobre el gas en esta expansión cuasiestática?
- ¿Cuánto calor entra en el gas en la expansión cuasiestática?
1.9 Termómetro de gas
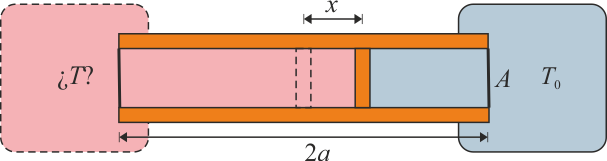
Se construye un termómetro de gas ideal según el siguiente principio: un tubo cilíndrico de sección A y longitud 2a con paredes adiabáticas y bases diatermas es dividido por un pistón, también adiabático, que puede deslizarse sin rozamiento por el interior del tubo. En el interior de las dos cámaras se encuentra un gas ideal. Una de las dos cámaras se mantiene en contacto térmico con un foco a temperatura T0, mientras que la otra se pone en contacto con el sistema cuya temperatura se quiere medir. Cuando las dos temperaturas son iguales el pistón se encuentra en la posición central y la presión del gas es p0.
- Calcule la temperatura absoluta T a la que se encuentra el sistema cuando el pistón se ha desplazado una cantidad x desde el centro hacia el sistema a T0. ¿Resulta una escala lineal de temperaturas? ¿A cuánto tiende x si
 o si
o si 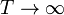 ?
?
- Supongamos que se parte del equilibrio a T0 y que la variación de la temperatura del gas de la cámara exterior y el desplazamiento del pistón en x ha sido de forma cuasiestática y reversible. ¿Cuáles son los calores, trabajos e incrementos de energía interna para cada una de las cámaras y para el tubo completo, como función del desplazamiento x del pistón?
- Supongamos que el tubo mide 20 cm, la temperatura de referencia es
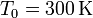 y el pistón se desplaza 1 cm. ¿Cuál es la temperatura del sistema exterior?
y el pistón se desplaza 1 cm. ¿Cuál es la temperatura del sistema exterior?
- Si además sabemos que la sección del tubo es de 10 cm², el gas contenido es aire y la presión inicial es
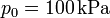 , ¿cuánto valen los calores, trabajos e incrementos de energía interna del segundo apartado?
, ¿cuánto valen los calores, trabajos e incrementos de energía interna del segundo apartado?
1.10 Cuatro procesos no cuasiestáticos
Se tiene un cilindro horizontal cerrado por un pistón, en cuyo interior hay aire seco (considerado un gas ideal diatómico). Inicialmente, el aire interior se encuentra a 450 kPa y 333 K, ocupando un volumen de 1000 cm³. El ambiente se encuentra a 100 kPa y 296 K, valores que no cambian en ningún momento.
Las paredes del cilindro son adiabáticas. El pistón está inicialmente limitado por un tope y forrado de forma que está aislado térmicamente.
Se realiza entonces el siguiente proceso compuesto:
- A→B Se libera bruscamente el tope, dejando que el gas se expanda sin quitarle el aislante térmico.
- B→C Una vez que se ha alcanzado de nuevo el equilibrio y sin volver a fijar la tapa, se quita bruscamente el aislante térmico, dejando que el sistema evolucione.
Ninguno de los dos pasos es cuasiestático.
Para este proceso
- a.1 Calcule la presión, volumen y temperatura del gas en los estados B y C.
- a.2 Halle el trabajo y el calor netos que entran en el sistema, así como la variación de energía interna, en los pasos A→B y B→C.
Suponga ahora que, partiendo del mismo estado inicial se realizan los dos desbloqueos en orden inverso, es decir,
- A→D Se quita bruscamente el aislante térmico, sin quitar el tope
- D→E Sin volver a poner el aislante, se libera bruscamente el tope.
Ninguno de los dos pasos es cuasiestático.
Para este nuevo proceso, calcule las mismas magnitudes que en el caso anterior, es decir:
- b.1 Calcule la presión, volumen y temperatura del gas en los estados D y E.
- b.2 Halle el trabajo y el calor netos que entran en el sistema, así como la variación de energía interna, en los pasos A→D y D→E.
1.11 Proceso irreversible de 4 pasos
Una cierta cantidad de aire seco (considerado como gas ideal diatómico) se encuentra contenido en un cilindro de sección cuadrada de 10 cm de lado, cerrado por un pistón móvil situado inicialmente a 16 cm del fondo. El aire interior se encuentra inicialmente (estado A) a 300 K de temperatura (que es la del ambiente en todo momento) y a la presión atmosférica de 0.1 MPa.
Se le aplica a este gas el siguiente proceso cíclico
- A→B Se aumenta bruscamente la presión aplicada a 0.8 MPa, de forma que se produce una compresión muy rápida, que puede aproximarse por un proceso adiabático irreversible.
- B→C Manteniendo la presión exterior de 0.8 MPa se espera hasta que vuelva a alcanzar el equilibrio térmico con el ambiente.
- C→D Se retira bruscamente la presión exterior, dejándola en su valor inicial de 0.1 MPa. Se produce una expansión brusca que puede aproximarse por un proceso adiabático irreversible.
- D→A Manteniendo la presión exterior de 0.1 MPa se espera hasta que vuelva a alcanzar el equilibrio térmico con el ambiente.
Para este ciclo
- Calcule los valores de la presión, volumen y temperatura al final de cada paso. Indique los estados, así como los procesos oportunos en un diagrama pV
- Halle el trabajo y el calor que entran en el sistema en cada paso, así como las variaciones de energía interna y entalpía en cada uno.
- Calcule, para un ciclo completo, el trabajo que entra y el que sale del sistema, así como el calor que entra y el que sale.
- ¿Es este sistema un refrigerador? ¿Una máquina térmica? ¿Una estufa?
2 Problemas adicionales
2.1 Calor necesario para evaporar hielo
Calcule la cantidad de calor necesaria para llevar un bloque de hielo de 500 g inicialmente a −10 °C hasta el estado de vapor de agua a 115 °C, manteniéndose la presión constante en 101.3 kPa.
2.2 Calentamiento de un gas a volumen y a presión constante
Un cilindro de 10 cm de diámetro está cerrado por un émbolo. La presión exterior es en todo momento de 100 kPa. La cámara está llena de aire que se encuentra inicialmente a 300 K y el émbolo está a una distancia de 10 cm respecto del fondo. Se calienta cuasiestáticamente el gas hasta que su temperatura llega a 450 K. Calcule el calor que entra el gas, el trabajo que se realiza sobre él, así como la variación de su energía interna y de su entalpía:
- Si el émbolo está bloqueado de forma que no puede desplazarse.
- Si el émbolo está libre y puede deslizarse sin rozamiento por el tubo.
2.3 Proceso con presión proporcional a volumen
Se tiene un volumen de 1 m³ de un gas ideal diatómico (γ = 1.4), a 100 kPa y 300 K. Sobre este gas se realiza un proceso cuasiestático en el que se aumenta gradualmente su presión y volumen de forma que en todo momento su presión es proporcional al volumen ocupado, p = λV. Al final del proceso, el volumen del gas es de 3 m³.
- Halle la temperatura final del gas.
- Calcule el trabajo realizado sobre el gas en este proceso.
- Determine la variación de la energía interna del gas y el calor que entra en él en el proceso.
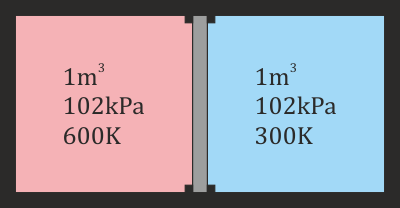
2.4 Paso de calor entre dos cámaras rígidas
Un recipiente adiabático de 2 m³ está dividido en dos cámaras cúbicas del mismo tamaño, separadas por una pared inmóvil rellena de un aislante térmico. Las dos cámaras están llenas de aire seco. La de la izquierda contiene aire a 102 kPa y 600 K. El aire de la derecha está también a 102 kPa, pero a 300 K. Sin quitar la pared central se retira el aislante térmico que contiene, permitiendo que las dos cámaras entren en contacto térmico entre sí (no con el exterior)
- Determine la temperatura final de equilibrio y la cantidad de calor que pasa de una cámara a la otra.
- Halle la fuerza sobre la pared central una vez que se ha alcanzado el equilibrio térmico.
Datos Constante universal de los gases ideales: 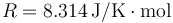 ; cociente entre capacidades caloríficas para el aire γ = 1.4.
; cociente entre capacidades caloríficas para el aire γ = 1.4.
2.5 Trabajo en fusión de hielo
Tenemos 1 kg de hielo (densidad de masa 917 kg/m³) a 0 °C, al cual se le cede lentamente calor a una presión de 101.3 kPa hasta que convierte por completo en agua (densidad de masa 1000 kg/m³). Para este proceso, halle
- El calor que entra en el sistema
- El trabajo realizado sobre el sistema
- La variación de entalpía y de energía interna del sistema
2.6 Congelamiento gradual de un estanque
Un estanque de agua a 0 °C está cubierto por una capa de hielo de 4.00 cm de espesor. Si la temperatura del aire permanece constante a -10.0 °C, ¿cuánto tardará el espesor de la capa de hielo en alcanzar los 8.00 cm?
La conductividad térmica del hielo es 2.22 W/m·K y la entalpía de fusión del agua vale 334 kJ/kg.
2.7 Trabajo en un gas con resorte
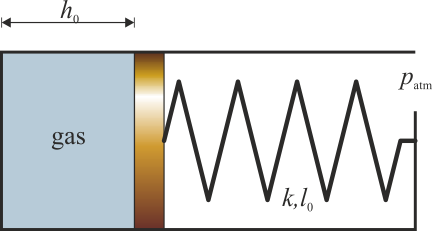
Se tiene un cilindro de sección S en el interior del cual hay un pistón que puede deslizarse sin rozamiento. El pistón cierra una cámara en la que hay un gas ideal. La cara exterior del pistón está unida al extremo del tubo mediante un resorte de constante k y longitud natural l0. Esta parte del tubo está abierta a la atmósfera. Para un cierto valor de la temperatura, T0, la presión es la atmosférica, el pistón se encuentra a una distancia h0 del fondo y el resorte no ejerce fuerza alguna. Cuando el gas se calienta, se expande y el resorte se comprime.
- Halle el trabajo realizado sobre el gas cuando su temperatura pasa de T0 a T1.
- Calcule la variación de la energía interna del gas y el calor transferido al gas en el proceso.
- Calcule el trabajo, la variación en la energía total y el calor, si consideramos que el sistema esta formado por el gas y el muelle.
2.8 Masa que cuelga de una cámara de aire
Se tiene una balanza formada por un recipiente cilíndrico de 16 cm² de sección lleno de aire (considerado como un gas ideal). El tubo está cerrado herméticamente en su parte inferior por un émbolo que puede deslizarse sin rozamiento y que tiene un gancho en su cara inferior. Las paredes y el émbolo no están aislados térmicamente. Inicialmente el émbolo se encuentra a 15 cm de la pared superior, y el gas en equilibrio mecánico y térmico con el exterior, que se halla a 1 bar y 300 K. Se cuelga bruscamente del pistón un saco de harina de 4 kg.
- ¿Cuánto desciende aproximadamente el pistón hasta que se alcanza de nuevo el equilibrio?
- ¿Cuánto vale aproximadamente el calor que entra en el sistema en este proceso?
- Suponga que el saco tiene un agujero, de forma que la harina se escapa lentamente hasta vaciarse por completo (despreciamos el peso del propio saco). ¿Cuánto vale el calor que entra en el sistema en este segundo proceso?
- ¿Cuánto varía la entropía del sistema, del ambiente del universo en el descenso? ¿Y en el ascenso ulterior?
- Supongamos que la cámara y el pistón están aislados térmicamente, de manera que los procesos son adiabáticos. ¿Cómo quedan en ese caso los resultados de los apartados anteriores?
2.9 Calor que escapa por una ventana
En una habitación que se encuentra a una temperatura de 22 °C se encuentra una ventana de 1.60 m por 1.20 m. con un vidrio de 5 mm de espesor. El exterior de la habitación se halla a 10 °C. Determine aproximadamente la cantidad de calor que escapa de la habitación por segundo. La conductividad térmica del vidrio es de 0.96 W/m·K.
Suponga ahora que delante de la ventana se colocan unos finos visillos de espesor despreciable, estando los visillos a 2 cm de la ventana. ¿Cuál es entonces la cantidad de calor que escapa de la ventana por segundo? La conductividad térmica del aire vale 0.024 W/m·K
2.10 Calor que escapa del cuerpo humano
Determine la cantidad de calor que escapa por cm² de piel del cuerpo humano si la piel se encuentra a 33 °C y el aire exterior se encuentra a 15 °C, estando el cuerpo cubierto por una sábana de algodón de 1 mm de espesor. ¿Y si además de la sábana está tapado con una manta de lana de 5 mm de espesor? La conductividad térmica de la lana es 0.03 W/m·K y la del algodón 0.04 W/m·K.
2.11 Fusión de un trozo de hielo
Se tiene un bloque de hielo de masa 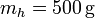 sumergido en un volumen de agua de masa
sumergido en un volumen de agua de masa 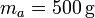 , ambos a una temperatura
, ambos a una temperatura 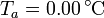 . El conjunto está contenido en un recipiente cilíndrico
de vidrio, de diámetro
. El conjunto está contenido en un recipiente cilíndrico
de vidrio, de diámetro 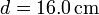 y espesor
y espesor 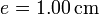 , abierto por arriba al aire (que se puede suponer un aislante térmico perfecto). El recipiente está sumergido en un baño de agua a
, abierto por arriba al aire (que se puede suponer un aislante térmico perfecto). El recipiente está sumergido en un baño de agua a 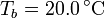 .
.
- Calcule la superficie de agua en contacto con el recipiente y la cantidad de calor que entra en él en 1.00 s.
- Halle la cantidad de hielo que se funde en el mismo tiempo. ¿Cuánto tiempo tardará aproximadamente en derretirse por completo?
Datos: Densidad de masa del agua líquida 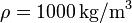 ; Conductividad térmica del vidrio
; Conductividad térmica del vidrio 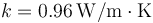 ; Entalpía específica de fusión:
; Entalpía específica de fusión: 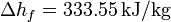 .
.
3 Preguntas de test
3.1 Calor en el calentamiento de un gas
Si un gas ideal se calienta a presión constante, ¿cómo se relacionan el calor que entra y la variación de la energía interna?
- A Qin > ΔU
- B Qin < ΔU
- C Qin = ΔU
- D Puede darse cualquiera de las tres situaciones anteriores.
3.2 Energía y trabajo en el calentamiento de un gas
En una expansión cuasiestática de un gas ideal a presión constante, ¿cuánto vale el incremento de la energía interna del gas y el trabajo realizado sobre él?
- A
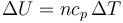 ;
; 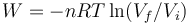 .
.
- B
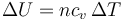 ;
; 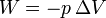 .
.
- C
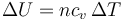 ;
; 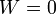 .
.
- D
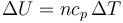 ;
; 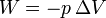 .
.
- A
3.3 Mezcla de aguas
En un recipiente con paredes diatermas se mezclan 1000 cm³ de agua a 60°C con 3000 cm³ de agua a 20°C, que también es la temperatura exterior. ¿Cuál es la temperatura final del agua en el equilibrio?
- A 40°C
- B 30°C
- C 80°C
- D 20°C.
3.4 Trabajo en la fusión del hielo
Tenemos 1 kg de hielo (densidad de masa 917 kg/m³) a 0°C, al cual se le cede lentamente calor a una presión de 101.3 kPa hasta que convierte por completo en agua (densidad de masa 1000 kg/m³). ¿Qué trabajo se realiza sobre el sistema?
- A −9.15 J.
- B Ninguno.
- C +9.15 J.
- D −9.15 kJ.
3.5 Flujo de calor en esfera
Un recipiente esférico de vidrio (con conductividad térmica 0.96 W/m·K) de 10 cm de radio y 2 mm de espesor está lleno de agua a 10 °C, estando el aire exterior a 20 °C. ¿Cuánto vale el flujo de calor que entra en la esfera?
- A +201 W
- B +480 W
- C +603 W
- D −201 W
3.6 Agua necesaria para fundir hielo
¿Cuanta agua a 20°C es aproximadamente necesaria para fundir por completo 100 g de hielo a 0°C?
- A 4.0 kg
- B 8.0 kg
- C 400 g
- D 80 kg
3.7 Calor que atraviesa una ventana
Una ventana aislante está formada por un vidrio (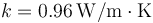 ) de 5 mm de espesor, una capa de aire (
) de 5 mm de espesor, una capa de aire (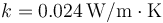 ) de 2 cm y otro vidrio de 5 mm. ¿Cuánto vale la resistencia térmica de 1 m² de ventana?
) de 2 cm y otro vidrio de 5 mm. ¿Cuánto vale la resistencia térmica de 1 m² de ventana?
- A 385 K/W
- B 1.19 K/W
- C 2.60 mK/W
- D 0.84 K/W
3.8 Comparación de tres procesos
Para los procesos cuasiestático de la figura, correspondientes a un gas ideal…

¿En cuál es mayor la variación de la energía interna?
- A En el proceso 3.
- B En el proceso 1.
- C Tiene el mismo valor en los tres procesos.
- D En el proceso 2.
¿En cuál es mayor el calor absorbido por el gas?
- A En el proceso 2.
- B En el proceso 1.
- C Tiene el mismo valor en los tres procesos.
- D En el proceso 3.
3.9 Expansión con aumento de presión
Se tiene una cantidad fija de un gas ideal diatómico situada a una presión p0, volumen V0 y temperatura T0. Experimenta un proceso tal que la presión final es 2p0 y el volumen 2V0.
El incremento de la energía interna en este proceso vale…
- A 0
- B (15 / 2)p0V0
- C − (15 / 2)p0V0
- D (5 / 2)p0V0
Supongamos que el proceso anterior ocurre de manera cuasiestática según la ley
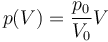
¿Cuánto trabajo se realiza sobre el gas en esta expansión cuasiestática?
- A + (3 / 2)p0V0
- B + (5 / 2)p0V0
- C − (3 / 2)p0V0
- D 0
¿Cuánto calor entra en el gas en la expansión cuasiestática?
- A − 9p0V0
- B 9p0V0
- C 0
- D Depende de si el recipiente es adiabático o no.
3.10 Equivalencia de una BTU
Una British Thermal Unit (BTU) es la energía necesaria para elevar la temperatura de 1 libra de agua (1 lb = 0.454 kg) de 39°F a 40°F (siendo 1.8°F = 1°C). Si el calor específico del agua es igual a 4.186 kJ/(kg·°C), ¿a qué equivale 1 BTU en el SI?
- A 3.420 kJ
- B 5.123 kJ
- C 1.055 kJ
- D 16.59 kJ
3.11 Trabajo en un ciclo
¿Qué trabajo neto realiza sobre el ambiente en un ciclo una máquina que realiza el siguiente ciclo termodinámico?
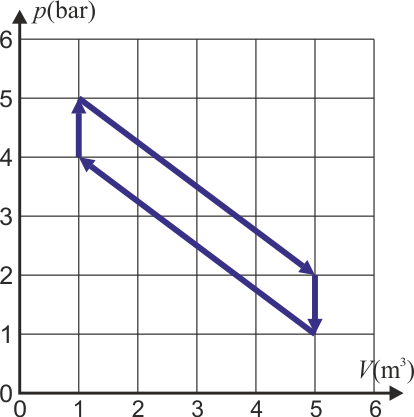
- A +400 kJ
- A −500 kJ
- A −400 kJ
- A +500 kJ
3.12 Tubo con dos cámaras
Un tubo de sección S está dividido en dos cámaras de longitud L. Las paredes son adiabáticas y la pared central es inamovible y está forrada de aislante térmico. Inicialmente, en la cámara de la izquierda (1) hay aire a temperatura T1 = T0 y presión p0 y en la de la derecha (2) aire a T2 = 3T0 y la misma presión. Se retira el aislante del tabique central (sin eliminar el tabique).
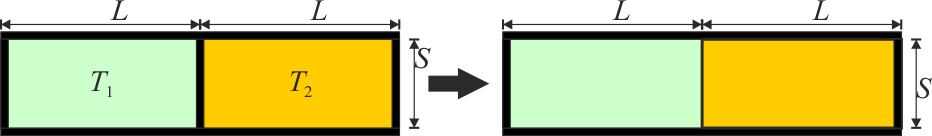
¿Cuál es la relación entre las masas de aire en las dos cámaras?
- A m2 = 3m1
- B m1 = m2
- C m1 = 9m2
- D m1 = 3m2
¿Qué ecuación, de las siguientes, permite calcular la temperatura de equilibrio final? (los subíndices se refieren a cada una de las dos cámaras).
- A ΔS1 + ΔS2 = 0
- B W2out = W1in
- C p1f = p2f, T1f = T2f.
- D ΔU1 + ΔU2 = 0
¿Cuál es dicha temperatura final de las cámaras?
- A Tf = 4T0
- B Tf = 2T0
- C Tf = T0
- D Tf = 3T0 / 2
En el equilibrio final, ¿cómo es la fuerza sobre la pared central?
- A Apunta hacia la cámara 1.
- B Es nula.
- C Apunta hacia la cámara 2.
- D Puede apuntar en cualquiera de los dos sentidos, dependiendo del valor de T0.
3.13 Expansión adiabática y temperatura
En una expansión adiabática de un gas ideal, si T1 es su temperatura inicial y T2 es la final, ¿qué relación existe entre ellas?
- A T2 > T1.
- B T2 < T1.
- C T2 = T1.
- D Puede darse cualquiera de las otras tres situaciones, dependiendo de si el proceso es reversible o no.
3.14 Masa que cuelga de una cámara de aire
Se tiene una balanza formada por un recipiente cilíndrico de 16 cm² de sección lleno de aire (considerado como un gas ideal). El tubo está cerrado herméticamente en su parte inferior por un émbolo que puede deslizarse sin rozamiento y que tiene un gancho en su cara inferior. Las paredes y el émbolo no están aislados térmicamente. Inicialmente el émbolo se encuentra a 15 cm de la pared superior, y el gas en equilibrio mecánico y térmico con el exterior, que se halla a 1 bar y 300 K. Se cuelga bruscamente del pistón un saco de harina de 4 kg.
¿Cuánto desciende aproximadamente el pistón hasta que se alcanza de nuevo el equilibrio?
- A 3 cm.
- B 5 cm.
- C 3 mm.
- D 0 cm.
¿Cuánto vale aproximadamente el calor que entra en el sistema en este proceso?
- A +5.9 J
- B −6.7 J
- C 0 J
- D +6.7 J
Suponga que el saco tiene un agujero, de forma que la harina se escapa lentamente hasta vaciarse por completo (despreciamos el peso del propio saco). ¿Cuánto vale el calor que entra en el sistema en este segundo proceso?
- A +5.9 J
- B −6.7 J
- C 0 J
- D +6.7 J
3.15 Variación del calor por radiación
Se calienta un trozo de metal de 300 K a 900 K. ¿Cómo cambia la cantidad de calor que escapa del metal por radiación?
- A Se multiplica por 3.
- B Se divide por 3.
- C Se multiplica por 9.
- D Se multiplica por 81.
3.16 Proceso de un gas diatómico
Un gas ideal diatómico experimenta un proceso cuasiestático desde un estado A a un estado B, según la gráfica de la figura
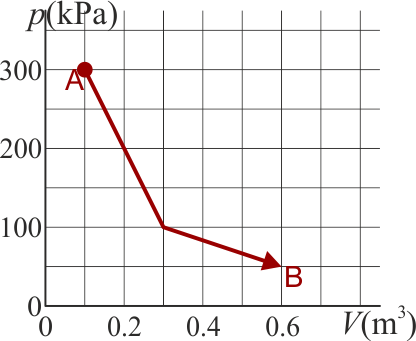
¿Cuánto es la variación de la energía interna del gas?
- A No podemos conocerlo sin saber el número de moles.
- B Es nula.
- C +62.5 kJ
- D −53.7 kJ
¿Cuánto calor entra en el gas en este proceso?
- A −53.7 kJ
- B No podemos conocerlo sin saber el número de moles.
- C +62.5 kJ
- D +53.7 kJ
3.17 Aluminio sobre hielo
Un bloque de aluminio de 4 kg a 80 °C se coloca sobre un gran bloque de hielo a 0 °C. ¿Cuánto hielo se derrite, aproximadamente? (calor específico del aluminio: 0.897 kJ/(kg·K); calor específico del agua: 4.18 kJ/(kg·K); entalpía específica de fusión del agua: 333.55 kJ/kg)
- A 215 g
- B 4.0 kg
- C 860 g.
- D 11 g
3.18 cámara que deja de estar aislada
Se tiene una cierta cantidad de aire en un cilindro con paredes adiabáticas y con un pistón también adiabático, que puede moverse pero permanece en reposo, situado en un ambiente a presión p0 y temperatura T0. Al retirar el aislamiento térmico del cilindro, se encuentra que el pistón comprime el gas.
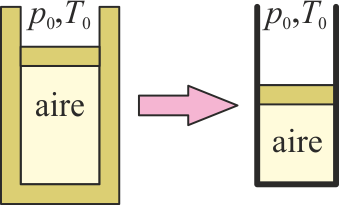
Antes de retirar el aislamiento, ¿había equilibrio entre el aire y el ambiente?
- A Había equilibrio tanto térmico como mecánico.
- B No había equilibrio ni térmico ni mecánico.
- C Había equilibrio mecánico, pero no térmico.
- D Había equilibrio térmico, pero no mecánico.
¿Qué podemos decir de la temperatura inicial del gas, Ti?
- A No podemos saber nada de la temperatura inicial.
- B Ti = T0
- C Ti > T0
- D Ti < T0
3.19 Otro proceso sobre un gas
Un gas ideal diatómico ocupa un cierto volumen V0 a una presión p0 y una temperatura T0. Primero, manteniendo constante su volumen, se reduce lentamente su presión a p0 / 2. Luego, manteniendo constante su nueva presión, se pone gradualmente en contacto con un foco a temperatura T0
¿Como se relacionan el volumen inicial, V0, y final Vf, del gas?
- A Vf = V0
- B Vf = V0 / 2
- C Vf = 2V0
- D Vf = 4V0
¿Cuánto trabajo intercambia el gas en este proceso?
- A Win = p0V0 / 2
- B Wout = p0V0 / 2
- C Win = p0V0
- D Wout = p0V0
3.20 Proceso de un gas ideal
Un gas ideal diatómico ocupa inicialmente un volumen de 0.2 m³ a 1 bar y 300 K. Se comprime cuasiestáticamente hasta que su volumen es 0.1 m³ según el proceso (p en bares, V en m³)
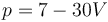
Para este proceso, ¿cuánto trabajo se realiza sobre el gas?
- A +20 kJ
- B −0.25 J.
- C +25 kJ
- D −25 kJ
¿Cuánto varía su energía interna?
- A +0.20 J
- B +25 kJ
- C +50 kJ
- D −50 kJ





