Cuatro procesos no cuasiestáticos
De Laplace
Contenido |
1 Enunciado
Se tiene un cilindro horizontal cerrado por un pistón, en cuyo interior hay aire seco (considerado un gas ideal diatómico). Inicialmente, el aire interior se encuentra a 450 kPa y 333 K, ocupando un volumen de 1000 cm³. El ambiente se encuentra a 100 kPa y 296 K, valores que no cambian en ningún momento.
Las paredes del cilindro son adiabáticas. El pistón está inicialmente limitado por un tope y forrado de forma que está aislado térmicamente.
Se realiza entonces el siguiente proceso compuesto:
- A→B Se libera bruscamente el tope, dejando que el gas se expanda sin quitarle el aislante térmico.
- B→C Una vez que se ha alcanzado de nuevo el equilibrio y sin volver a fijar la tapa, se quita bruscamente el aislante térmico, dejando que el sistema evolucione.
Ninguno de los dos pasos es cuasiestático.
Para este proceso
- a.1 Calcule la presión, volumen y temperatura del gas en los estados B y C.
- a.2 Halle el trabajo y el calor netos que entran en el sistema, así como la variación de energía interna, en los pasos A→B y B→C.
- a.3 Halle la variación de entropía del sistema, del ambiente y del universo en cada uno de los dos pasos.
Suponga ahora que, partiendo del mismo estado inicial se realizan los dos desbloqueos en orden inverso, es decir,
- A→D Se quita bruscamente el aislante térmico, sin quitar el tope
- D→E Sin volver a poner el aislante, se libera bruscamente el tope.
Ninguno de los dos pasos es cuasiestático.
Para este nuevo proceso, calcule las mismas magnitudes que en el caso anterior, es decir:
- b.1 Calcule la presión, volumen y temperatura del gas en los estados D y E.
- b.2 Halle el trabajo y el calor netos que entran en el sistema, así como la variación de energía interna, en los pasos A→D y D→E.
- b.3 Halle la variación de entropía del sistema, del ambiente y del universo en cada uno de los dos pasos.
2 Introducción
En este sistema tenemos una cantidad de aire rodeado por el ambiente.
La presencia del tope impide que se alcance el equilibrio mecánico. Si se retira, se llega al equilibrio mecánico, igualándose la presión a la exterior.
La presencia del aislante térmico hace que las paredes sean adiabáticas e impide que se llegue al equilibrio térmico. Si se retira, sí se alcanza este equilibrio.
Si se retiran los dos bloqueos, se alcanzan los dos equilibrios.
Por tanto, habrá estados en que la presión y/o la temperatura sea la misma que la ambiente.
Con eso y con la ayuda de la ley de los gases ideales y del primer principio de la termodinámica, pueden determinarse las variables que faltan.
En cuanto a los procesos en sí, hay que destacar que, como se dice en el propio enunciado, NO son cuasiestáticos y por tanto:
- NO se pueden representar como una curva en un diagrama pV.
- NO se puede usar la ley de Poisson, que es solo para procesos adiabáticos cuasiestáticos.
- NO se puede hallar el trabajo empleando la fórmula de un proceso isotermo, con el logaritmo, ya que esa solo vale para procesos cuasiestáticos.
Los procesos son los siguientes:
- A→B
- proceso adiabático (NO isotermo) no cuasiestático, con una presión externa constante.
- B→C
- proceso a presión constante (isóbaro)
- A→D
- proceso a volumen constante (isócoro)
- D→E
- proceso a temperatura constante (isotermo) no cuasiestático.
3 Presiones, volúmenes y temperaturas
Comenzamos anotando los datos que conocemos e iremos rellenando los que podamos deducir de estos empleando la ley de los gases ideales y el conocimiento de los diferentes procesos.
- Estado A
Del estado inicial A tenemos toda la información
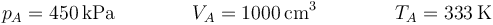
- Estado C
En el estado final C, el gas tiene la temperatura y la presión del ambiente, ya que ha alcanzado el equilibrio térmico y mecánico.

Mediante la ley de los gases ideales calculamos el volumen en el estado final C
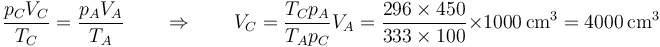
- Estado E
El estado E es exactamente el mismo que el C: de equilibrio mecánico y térmico con el ambiente. Por ello:
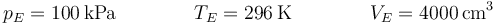
Quedan los estados B y D. Para ellos, debemos analizar los procesos.
- Estado B
Al estado B se llega cuando se retira el tope y de deja que el gas se expanda, sin quitar el aislante térmico. Esto quiere decir que en B hay equilibrio mecánico con el ambiente, pero no térmico. Por ello,
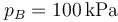
No sabemos la temperatura ni el volumen en este estado. Sí sabemos que el proceso A→B es adiabático, por lo que se cumple la igualdad
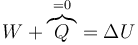
El proceso es adiabático, pero no cuasiestático. Por ello, no podemos emplear la ley de Poisson para hallar el nuevo estado. En su lugar, como en el problema de la pesa y el del saco debemos calcular el trabajo teniendo en cuenta que la presión exterior es constante

o, en términos de las variables del sistema,

Igualando esto a la variación de la energía interna
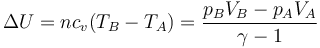
queda la ecuación
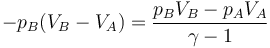
cuya solución, como en los dos problemas mencionados, vale
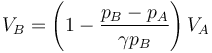
siendo su valor numérico
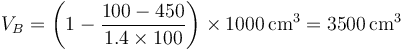
Una vez que tenemos el volumen, hallamos la nueva temperatura mediante la ley de los gases ideales
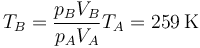
Vemos que la temperatura cae por debajo de la del ambiente. No hay problema en ello, pues el aislante térmico provoca que no haya equilibrio. Este es un caso de enfriamento adiabático: la expansión brusca de un gas hace bajar su temperatura.
- Estado D
Por último, queda el estado D. En este se retira el aislante térmico dejando el tope puesto. Por tanto su volumen es el mismo que el inicial
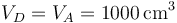
pero su temperatura se iguala a la del ambiente
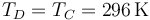
Con la ley de los gases ideales obtenemos la presión en este estado
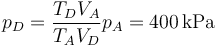
- Resumen
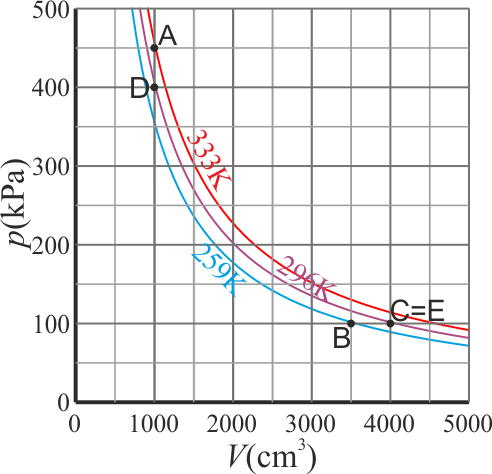
Con esto ya tenemos la tabla completa de todos los estados:
| Estado | p (kPa) | V (cm³) | T (K) |
|---|---|---|---|
| A | 450 | 1000 | 333 |
| B | 100 | 3500 | 259 |
| C | 100 | 4000 | 296 |
| D | 400 | 1000 | 296 |
| E | 100 | 4000 | 296 |
Gráficamente, podríamos situar los estados (pero no los procesos) en el siguiente diagrama pV
4 Trabajo, calor y energía interna
Una vez que tenemos los valores de las variables de estado hay cantidades que podemos calcular de forma inmediata. La variación de la energía interna, que es una función de estado, es una de ellas. En todos los casos podemos aplicar la fórmula
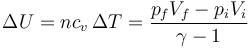
Para el trabajo y el calor debemos analizar qué proceso es en cada caso.
4.1 Proceso A→B
Cuando liberamos el pistón sin retirar el aislante térmico se produce una expansión adiabática, como ya dijimos. En este proceso

y la variación de la energía interna
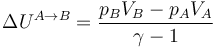
Sustituyendo los valores numéricos (usando que γ = 1.4)

El valor del trabajo es igual a esta variación en la energía

También podemos hallarlo teniendo en cuenta que es un trabajo a presión externa constante
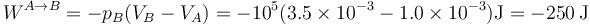
4.2 Proceso B→C
En el proceso de B a C la presión externa también se mantiene constante, por lo que podemos aplicar de nuevo la fórmula
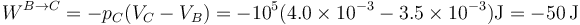
Para la variación en la energía interna aplicamos de nuevo que se trata de una función de estado
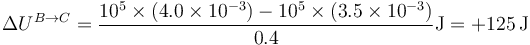
En este caso, el calor no es nulo, ya que el gas se expande y además se calienta
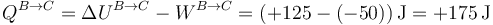
También se puede calcular este calor observando que se trata de un proceso a presión constante y

Más en general, puesto que la presión no cambia, podríamos hallar este calor como la variación en la entalpía.
4.3 Proceso A→D
Al mantenerse fijo el tope, el volumen permanece constante, por lo que no se hace trabajo sobre el gas
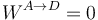
Para la variación en la energía interna aplicamos otra vez la misma fórmula
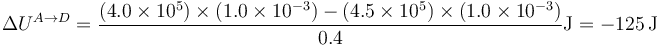
En este caso, el calor tampoco es nulo,
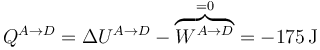
También se puede calcular este calor observando que se trata de un proceso a volumen constante

que por supuesto en este caso coincide con la variación en la energía interna.
4.4 Proceso D→E
Al igual que en el proceso B→C se mantenía constante la presión, porque previamente se había quitado el tope y ya estaba en equilibrio mecánico, en el proceso D→E se mantiene constante la temperatura, porque previamente se ha alcanzado el equilibrio térmico. Por ello
El trabajo no es cero. Este es un proceso isotermo, pero no podemos aplicar la fórmula con el trabajo en un proceso isotermo cuasiestático (la del logaritmo), ya que este proceso no es cuasiestático. Como en el problema de la pesa o el del saco hay que aplicar que se trata de un trabajo frente a una presión externa constante
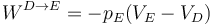
lo que nos da
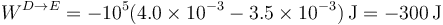
El calor lo calculamos a partir de este trabajo

4.5 Resumen
Reuniendo todos los resultados obtenemos la siguiente tabla
| Proceso | Q (J) | W (J) | ΔU (J) |
|---|---|---|---|
| A→B | 0 | −250 | −250 |
| B→C | +175 | −50 | +125 |
| A→D | −125 | 0 | −125 |
| B→C | −300 | +300 | 0 |
Vemos que como los estados C y E son el mismo, el proceso A → B → C y el proceso A → D → E son dos caminos diferentes entre los mismos estados. Por el primer principio de la termodinámica, la suma del calor y el trabajo es la misma en un camino que en el otro, aunque cada uno por separado (Q o W) pueda ser diferente.
5 Entropía
En el cálculo de la entropía debemos distinguir dos términos: el del sistema y el del ambiente.
Para el sistema, podemos aplicar que la entropía es una función de estado y por tanto solo precisamos los valores de la presión y la temperatura al principio y al final de cada paso. La variación de entropía del sistema será, por tratarse de un gas ideal,
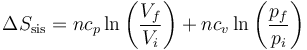
No hemos calculado el número de moles, pero no nos hace falta. Tenemos que
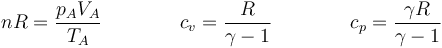
lo que nos permite hallar la entropía como
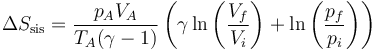
Por supuesto, también se puede calcular hallando los valores de n, cv y cp.
Para la entropía del ambiente, la transmisión de calor se produce siempre a temperatura constante, lo que nos da la variación

La variación de entropía del universo será la suma de estas dos.
Aplicando estas fórmulas a cada uno de los pasos obtenemos
5.1 Paso A→B
La variación de entropía del sistema vale
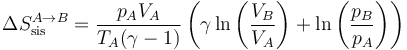
siendo su valor numérico
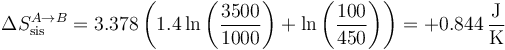
Para el ambiente, al ser el proceso adiabático
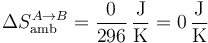
y para el universo

5.2 Paso B→C
Para el resto de los pasos operamos del mismo modo.
La variación de entropía del sistema es
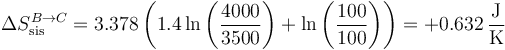
Para el ambiente,
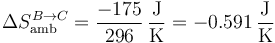
y para el universo
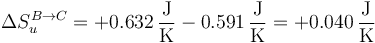
5.3 Paso A→D
La variación de entropía del sistema es
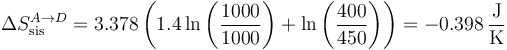
Para el ambiente,
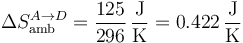
y para el universo
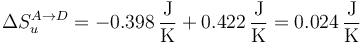
5.4 Paso D→E
La variación de entropía del sistema es
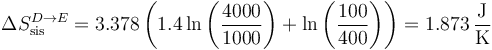
Para el ambiente,
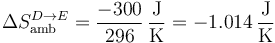
y para el universo
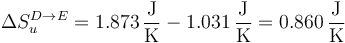
5.5 Resumen
Reuniendo todos los resultados obtenemos la siguiente tabla
| Proceso | ΔSsis (J/K) | ΔSamb (J/K) | ΔSu (J/K) |
|---|---|---|---|
| A→B | +0.844 | 0 | +0.844 |
| B→C | +0.632 | −0.591 | +0.040 |
| A→D | −0.398 | +0.422 | +0.024 |
| D→E | +1.873 | −1.014 | +0.860 |
Vemos que en todos los casos resulta una variación positiva para la entropía del universo, como corresponde a que todos los procesos sean no cuasiestáticos, y por tanto irreversibles.





