Masa que cuelga de una cámara de aire
De Laplace
Contenido |
1 Enunciado
Se tiene una balanza formada por un recipiente cilíndrico de 16 cm² de sección lleno de aire (considerado como un gas ideal). El tubo está cerrado herméticamente en su parte inferior por un émbolo que puede deslizarse sin rozamiento y que tiene un gancho en su cara inferior. Las paredes y el émbolo no están aislados térmicamente. Inicialmente el émbolo se encuentra a 15 cm de la pared superior, y el gas en equilibrio mecánico y térmico con el exterior, que se halla a 1 bar y 300 K. Se cuelga bruscamente del pistón un saco de harina de 4 kg.
- ¿Cuánto desciende aproximadamente el pistón hasta que se alcanza de nuevo el equilibrio?
- ¿Cuánto vale aproximadamente el calor que entra en el sistema en este proceso?
- Suponga que el saco tiene un agujero, de forma que la harina se escapa lentamente hasta vaciarse por completo (despreciamos el peso del propio saco). ¿Cuánto vale el calor que entra en el sistema en este segundo proceso?
- ¿Cuánto varía la entropía del sistema, del ambiente del universo en el descenso? ¿Y en el ascenso ulterior?
- Supongamos que la cámara y el pistón están aislados térmicamente, de manera que los procesos son adiabáticos. ¿Cómo quedan en ese caso los resultados de los apartados anteriores?
2 Introducción
Este problema es casi idéntico al “Trabajo en una compresión por un peso”, siendo la única diferencia esencial el que en ese otro problema la masa comprime el gas, aumentando la presión y en este lo expande, reduciéndola. No obstante, lo resolveremos de forma completa también aquí.
3 Descenso del pistón
Inicialmente (estado A) tenemos un gas a una presión y temperatura

y que ocupa un volumen
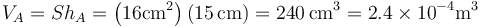
Cuando se cuelga el peso del pistón, disminuye la fuerza aplicada exteriormente sobre el gas, ya que a la presión atmosférica, que empuja hacia arriba hay que restarle la contribución del peso, que va hacia abajo. En ese momento la presión interior supera a la fuerza exterior y el gas se expande reduciendo su presión, hasta un nuevo valor pB.
El equilibrio se alcanza cuando la suma de fuerzas vuelve a ser nula. Considerando positivas las fuerzas que van hacia arriba y negativas las que van hacia abajo, sería

de donde la nueva presión interior vale
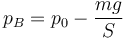
El resultado es idéntico al del otro problema, sin más que cambiar el signo del peso.
Podría pensarse que la nueva presión podría llegar a ser negativa, pero no es así. La presión atmosférica es tan grande que lo que se reduce por la acción del peso es solo una parte relativamente pequeña. Concretamente, tomando g = 10m/s²,

es decir, los 4kg ejercen una fuerza que es solo una cuarta parte de la que realiza la atmósfera. Con g = 9.8 m/s² serían 24500 Pa. Lo que estamos describiendo es el mismo principio que hace funcionar las ventosas. Podemos colgar una masa pequeña de una de ellas porque la presión atmosférica la mantiene sujeta debido a la diferencia de presiones. Eso sí, si se hiciera un orificio penetraría el aire exterior, se igualarían las presiones y el peso caería llevándose el pistón o la ventosa.
La nueva presión de equilibrio es entonces

Puesto que la temperatura no ha cambiado, podemos hallar el nuevo volumen empleando la ley de Boyle
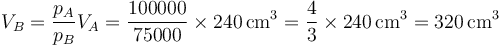
siendo la nueva distancia del pistón al techo

y el desplazamiento
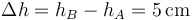
Con g = 9.8 m/s² serían 4.9 cm.
4 Calor
En este proceso la temperatura del gas es la misma al principio y al final del proceso, por lo que su energía interna no cambia
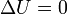
Por el primer principio de la termodinámica esto implica que se anula la suma del calor y el trabajo que entran en el gas en el proceso
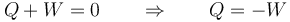
El trabajo que entra en el sistema es debido a la presión externa ejercida sobre él
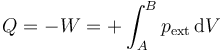
En esta expansión la presión ejercida desde el exterior es constante y equivale a la atmosférica menos la contribución debida al peso

lo que nos da el calor

Aquí podemos sustituir ya los valores numéricos
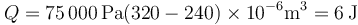
Algebráicamente podemos hallar una expresión más simple con ayuda de la ley de Boyle

que en términos del peso queda
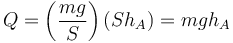
Numéricamente
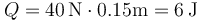
Este calor es positivo ya que al expandirse el gas realiza trabajo sobre el ambiente. Puesto que su energía interna no disminuye, esta salida de trabajo debe ser compensada por una entrada de calor
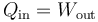
Con g = 9.8 m/s² serían 5.9 J.
5 Ascenso gradual del pistón
Una vez que se ha alcanzado el equilibrio, la masa de harina se va reduciendo progresivamente a medida que va cayendo harina del saco. Esto equivale a que la presión exterior va aumentando (ya que cada vez le restamos menos a la atmosférica), y el aire se vuelve a comprimir. En el nuevo estado final (estado C), la presión vuelve a ser la inicial. Puesto que la temperatura también es igual a la inicial, este estado C es igual al inicial, A.
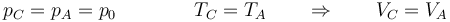
Al caer la harina lentamente, este segundo proceso puede suponerse cuasiestático. En este caso, en cada momento la presión interior equivale a la exterior, por lo que
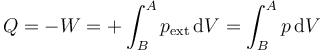
Puesto que la temperatura permanece constante, se trata de un proceso isotermo y cuasiestático. Aplicando la ley de Boyle
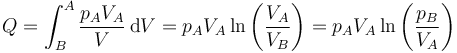
resultando el valor numérico para el calor
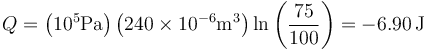
Con g = 9.8 m/s² serían &minus:6.7 J.
Vemos que el calor que sale en la compresión cuasiestático no coincide en magnitud con el que entra en la compresión no cuasiestático
6 Variación de entropía
6.1 Del sistema
La variación de entropía del gas la podemos calcular aplicando que se trata de una función de estado y que disponemos de la expresión para un gas ideal.
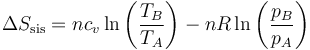
En esta caso, tanto a la ida como a la vuelta la temperatura inicial y la final son iguales, por lo que el primer término se anula en los dos casos.
En la expansión queda
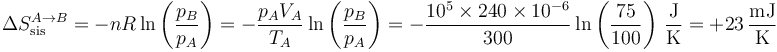
y en la compresión, puesto que se invierten los estados, será igual y de signo contrario

6.2 Del ambiente
El ambiente permanece en todo momento a la misma temperatura, por lo que desde el punto de vista del ambiente los procesos son isotermos y reversibles.
El cambio de entropía del ambiente en la expansión vale entonces
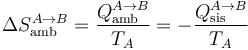
con valor numérico
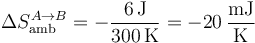
En la compresión se usa el mismo procedimiento, pero con el nuevo calor
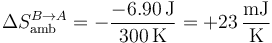
Vemos que en este caso las dos variaciones de entropía no son iguales y opuestas.
6.3 Del universo
Sumando las dos contribuciones, tenemos en la expansión
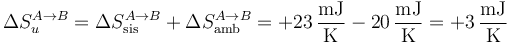
y en la compresión
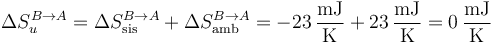
Resulta entonces que la expansión, causada por una diferencia finita de presiones, es un proceso irreversible con variación de entropía positiva. Sin embargo, la compresión, que es un proceso isotermo cuasiestático, es un proceso reversible, con variación de entropía nula.
7 Caso adiabático
7.1 Expansión
En el caso adiabático, es inmediato cuánto calor entra en el gas cuando la cámara se expande:
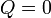
También es inmediata la variación de entropía del ambiente en el descenso

En un proceso adiabático, el ambiente intercambia trabajo con el sistema, pero no calor.
Para conocer el estado final tras la expansión brusca aplicamos el primer principio de la termodinámica
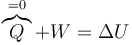
siendo el trabajo el debido a una presión externa constante
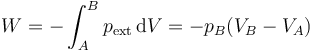
y la variación en la energía interna, suponiendo constante la capacidad calorífica molar,
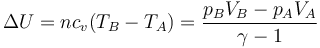
Igualamos las dos cantidades, lo que nos da el volumen final
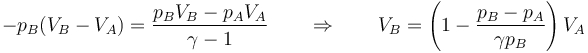
que numéricamente nos da
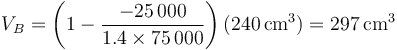
siendo la distancia final del pistón al techo
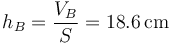
y el desplazamiento del pistón
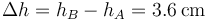
La temperatura del gas de la cámara tras la expansión la calculamos mediante la ley de los gases ideales
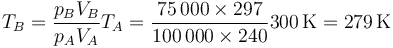
Vemos que el gas se enfría 21°C como consecuencia de la expansión, pasando a estar más frío que el ambiente. Esto no es problema pues al ser las paredes adiabáticas no tiene por qué haber equilibrio térmico entre el sistema y el ambiente.
La variación de entropía del gas en este proceso lo calculamos empleando la expresión para esta función de estado
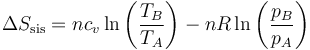
En este caso el primer término no se anula. Teniendo en cuenta que
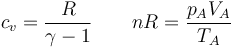
queda
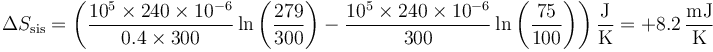
Puesto que la variación de entropía del ambiente es nula, esta es toda la variación de entropía del universo
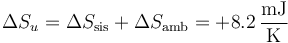
Puesto que es positiva, el proceso es posible e irreversible.
7.2 Compresión
La compresión posterior es gradual, al ir cayendo la harina poco a poco. Por tanto, podemos considerarla como un proceso adiabático cuasiestático.
Al final del proceso la presión vuelve a ser la misma que la inicial
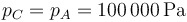
El volumen final, en cambio, no tiene por qué coincidir con el inicial, ya que no sabemos si la temperatura final coincide con la inicial. Al ser un proceso adiabático cuasiestático, podemos aplicar la ley de Poisson para calcular el estado final

que, despejando, nos da
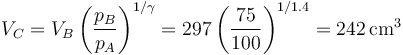
El estado final no coincide con el de partida, aunque está muy próximo a él. El volumen es 2 cm³ mayor, o en términos de la distancia al techo, se queda 1.2 mm más abajo.
La temperatura final del aire tampoco coincide exactamente con la inicial

El calor, en el proceso de subida es, como en el de bajada, nulo.
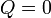
y también lo es la variación de entropía del ambiente

En esta subida, que es un proceso adiabático cuasiestático, la variación de entropía del sistema también es nula
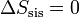
como se puede comprobar sin más que usar la misma fórmula que en los casos anteriores.
Al ser nula la variación de entropía del sistema y del ambiente, también lo es la del universo
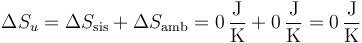
Tenemos entonces que tanto en el proceso de compresión isoterma cuasiestática como el de la compresión adiabática cuasiestática son procesos reversibles, pero que las variaciones de entropía del sistema (y del ambiente) son diferentes en un caso y en el otro.





