Problemas de procesos en gases ideales (GIA)
De Laplace
Contenido |
1 Problemas del boletín
1.1 Incremento de energía interna y trabajo en proceso isóbaro
Una cantidad fija de n moles de gas ideal sufre una transformación cuasiestática a presión constante P0, entre el estado inicial A(VA;TA), y el final B(VB;TB). ¿Cuál es la variación de energía interna experimentada por el gas en el proceso? ¿Qué cantidad de trabajo se ha transferido al sistema?
1.2 Expansión isoterma y adiabática
Un gas ideal monoatómico ocupa un volumen de 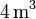 a la presión de
a la presión de 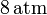 y a la temperatura de
y a la temperatura de
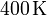 . El gas se expande hasta la presión final de
. El gas se expande hasta la presión final de
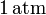 mediante un proceso cuasiestático. Calcule el
trabajo realizado, el calor absorbido y la variación de energía interna en
los siguientes casos:
mediante un proceso cuasiestático. Calcule el
trabajo realizado, el calor absorbido y la variación de energía interna en
los siguientes casos:
- Expansión isoterma.
- Expansión adiabática.
1.3 Obtención de las capacidades caloríficas de un gas
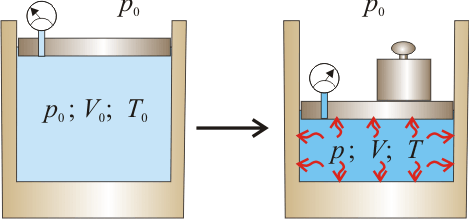
En el interior de un recipiente, cerrado mediante un pistón móvil, hay 4.48 litros de un gas ideal que inicialmente se encuentra a la presión de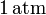 y
y 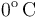 de temperatura. Las paredes del recipiente y el pistón pueden considerarse perfectamente impermeables al calor. Para determinar las características del gas se desplaza el pistón
de temperatura. Las paredes del recipiente y el pistón pueden considerarse perfectamente impermeables al calor. Para determinar las características del gas se desplaza el pistón
de manera cuasiestática, comprimiendo aquél hasta que su volumen se reduce a la mitad del inicial. Se mide la presión y se comprueba que ésta es ahora 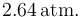
- ¿Cuál es el valor del coeficiente adiabático del gas? ¿Puede decir si se trata de un gas monoatómico o diatómico?
- Determine los valores de las capacidades caloríficas y los calores específicos molares del gas.
Dato: 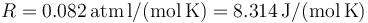
1.4 Energía interna, calor y trabajo en proceso cíclico
Una cierta cantidad de gas monoatómico ideal contenida en un recipiente hermético realiza el proceso cíclico representado en el diagrama P − V de la figura y que se describe a continuación:
En el estado inicial de equilibrio “A” ocupa un volumen V0, a una presión P0, en equilibrio térmico con un entorno que se encuentra a una temperatura T0. En primer lugar, el sistema experimenta una compresión isoterma “1”, por el cuál el gas reduce su volumen a la mitad del valor inicial, pero manteniendo constante la temperatura T0. Una vez alcanzado el estado “B”, el sistema verifica una expansión isóbara “2” (a presión constante) hasta el estado “C”, para recuperar el volumen V0 del estado inicial. Finalmente, en un último proceso isócoro “3” (a volumen constante), se reduce la presión del sistema hasta el valor inicial P0, alcanzando de nuevo el estado “A”. El proceso cíclico se realiza de manera que pueda considerarse que el gas se encuentra, en todo momento, en equilibrio termodinámico.- De manera razonada y sin necesidad de realizar cálculos, qué puede decir acerca de las variaciones de energía interna en cada uno de los tres procesos parciales que constituyen el proceso cíclico descrito.
- Determine los valores de presión, volumen y temperatura del sistema en los estados “B” y “C”, en función de los valores iniciales.
- Para cada uno de los procesos parciales, indique de manera razonada el “sentido” en que se verifican las transferencias de calor y trabajo. Indique, asimismo, cómo es la transferencia neta de calor y trabajo en el proceso completo.
- Calcule el rendimiento del ciclo, definido como la relación entre el trabajo neto (en valor absoluto) transferido en el proceso cíclico, y la cantidad de calor absorbido Qin (es decir, sólo el que entra en el sistema).
1.5 Proceso cíclico reversible de un gas ideal
Un sistema termodinámico consistente en n moles de un gas ideal monoatómico realiza un proceso cíclico. Inicialmente se encuentra en un estado “A” caracterizado por la terna de valores de presión, volumen y temperatura {P0,V0,T0}. La fase “1” del ciclo consiste en un proceso isócoro (a volumen constante) hasta el estado “B”, en el cuál su temperatura tiene un valor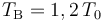 . En la fase “2” se expande isotérmicamente (a temperatura constante), hasta recuperar la presión inicial P0 en el estado “C”. A continuación realiza otro proceso isócoro “3” hasta el estado “D” para, finalmente, realizar un nuevo proceso isotermo “4” que termina en el estado “A”, completando el ciclo. Se asume que todas las fases del ciclo son procesos reversibles.
. En la fase “2” se expande isotérmicamente (a temperatura constante), hasta recuperar la presión inicial P0 en el estado “C”. A continuación realiza otro proceso isócoro “3” hasta el estado “D” para, finalmente, realizar un nuevo proceso isotermo “4” que termina en el estado “A”, completando el ciclo. Se asume que todas las fases del ciclo son procesos reversibles.
- Obtenga los valores de presión, volumen y temperatura en los estados “B”, “C” y “D”, en función de los correspondientes al estado “A”.
- En cada fase del proceso cíclico, calcule las cantidades de energía transferida en forma de calor y de trabajo. Determine también la variación de energía interna en cada fase.
- Calcule el trabajo neto realizado por el sistema en el ciclo (Wout − Win), y las cantidades de calor absorbido (Qin), y cedido (Qout).
- Calcule el rendimiento de esta máquina térmica, definido como el cociente entre el trabajo neto realizado y el calor absorbido en un ciclo. Compárelo con el rendimiento de una máquina térmica de Carnot que trabajase entre los mismos focos térmicos que la analizada.
2 Otros ejercicios
2.1 Trabajo en un ciclo de un gas perfecto
Las condiciones iniciales del estado de un gas perfecto son: V=4.00 l, P=2.00 atm, t = 27.0o C. Se dilata el gas a presión constante hasta duplicar su volumen. A continuación se comprime isotérmicamente hasta recuperar el volumen inicial. Finalmente se enfría a volumen constante hasta su presión inicial.
- Dibuja el ciclo en un diagrama PV.
- Calcula el trabajo realizado sobre el gas en el ciclo suponiendo que los procesos son cuasiestáticos.
2.2 Proceso isotérmico y adiabático en un gas perfecto
Se comprime un mol de aire en condiciones estándar mediante un proceso isotermo hasta reducir su volumen a la mitad, luego se expande adiabáticamente hasta recuperar su presión inicial. Ambos procesos son cuasiestáticos. Halle
- La temperatura final
- El trabajo total realizado por el gas
- El calor total absorbido por el gas
- La variación de energía interna
2.3 Expansión adiabática no cuasiestática de un gas ideal
4 moles de nitrógeno están a 25 oC y 30 atm. Se pasa bruscamente la presión hasta un valor de 10 atm mediante una expansión adiabática del gas contra una presión exterior constante de 10 atm. El proceso no es cuasiestático. Calcule
- La temperatura final del gas suponiendo que la ecuación de estado de los gases ideales es aplicable a los estados inicial y final.
- La variación de energía interna.
- El trabajo realizado sobre el gas.
- Compare con las mismas magnitudes en un proceso adiabático cuasiestático que expanda el gas hasta la misma presión final de 10 atm.