Trabajo en un ciclo
De Laplace
Contenido |
1 Enunciado
Las condiciones iniciales del estado de un gas perfecto son: V=4.00 l, P=2.00 atm, t = 27.0o C. Se dilata el gas a presión constante hasta duplicar su volumen. A continuación se comprime isotérmicamente hasta recuperar el volumen inicial. Finalmente se enfría a volumen constante hasta su presión inicial.
- Dibuja el ciclo en un diagrama PV.
- Calcula el trabajo realizado sobre el gas en el ciclo suponiendo que los procesos son cuasiestáticos.
2 Diagrama del ciclo
Los estados por los que pasa el sistema son los siguientes
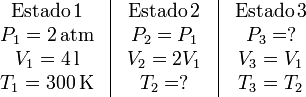
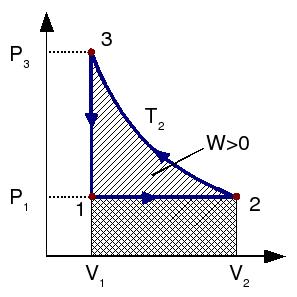
La figura muestra el ciclo representado en el diagrama PV.
3 Trabajo en el ciclo
El trabajo total realizado por el gas en el ciclo es la suma de los trabajos realizados en cada proceso. Vamos a calcular cada uno de ellos
3.1 Proceso isobárico
En este caso la presión es constante. Por tanto el trabajo es
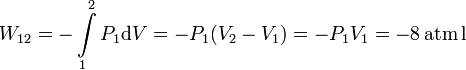
El trabajo es negativo, es decir, contribuye a disminuir la energía interna del gas. Es lógico, pues se trata de una expansión. En el diagrama PV, este trabajo corresponde al área bajo la línea horizontal que une los estados 1 y 2, con signo negativo.
3.2 Proceso isotermo
Ahora es la temperatura la que permanece constante en el proceso. Usamos la ecuación de estado del gas ideal para expresar la presión en función de la temperatura y el volumen
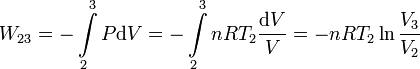
Utilizando de nuevo la ecuación de estado del gas ideal, obtenemos nRT2 = P2V2. El trabajo final es
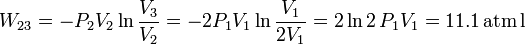
Ahora el trabajo es positivo, pues es una compresión. En el diagrama, corresponde al área bajo la hipérbola que une los estados 2 y 3. En este caso, el trabajo es positiva pues la curva se recorre de derecha a izquierda, en sentido contrario a como se realizó el proceso 12.
3.3 Proceso isócoro
En este último proceso el volumen permanece constante, por tanto, el gas no realiza trabajo.
W31 = 0
3.4 Trabajo total
El trabajo total es la suma del trabajo en cada uno de los procesos de los que se compone el ciclo. Por tanto
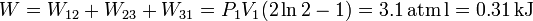
Como vemos, el trabajo total es positivo, el gas recibe una transferencia de energía neta a través del trabajo. Como el proceso es cíclico, la energía interna es la misma al empezar que al terminar, pues es una función de estado. Esto nos permitiría afirmar que el calor transferido al gas es negativo, es decir
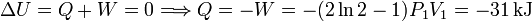
En el diagrama PV el trabajo es igual al área encerrada en el ciclo. En este caso es positivo pues el ciclo se recorre de modo que el área encerrada queda a la izquierda. De este modo, el proceso 23, donde el trabajo es positivo, compensa el proceso 12, donde el trabajo es negativo. Si quisiésemos que el gas proporcionara un trabajo (por ejemplo, para mover un pistón o un cigüeñal), tendríamos que recorrer el ciclo en sentido inverso, de modo que el trabajo neto sobre el gas fuese negativo. Esto es una característica general de los ciclos termodinámicos que modelan el funcionamiento de máquinas térmicas. El trabajo realizado en una parte del ciclo se compensa con el realizado en la otra, de modo que el resultado final sea positivo o negativo según interese.
3.5 Gas ideal diatómico
Con los datos del problema no podemos saber el calor transferido y la variación de energía interna en los procesos individuales. Para ello tenemos que conocer el calor específico del gas, ya sea a volumen o presión constante. Supongamos que el gas es diatómico. Entonces sabemos que los calores específicos molares son

Ahora sí podemos calcular los calores transferidos y la variación de energía interna en cada porceso
3.5.1 Proceso 1 a 2
El proceso es a presión constante
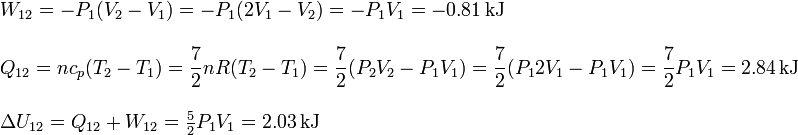
3.5.2 Proceso 2 a 3
El proceso es a temperatura constante
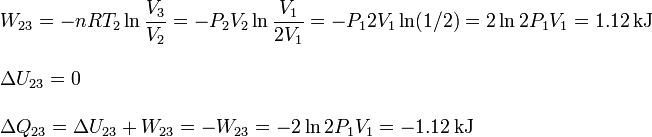
3.5.3 Proceso 3 a 1
El proceso es a volumen constante
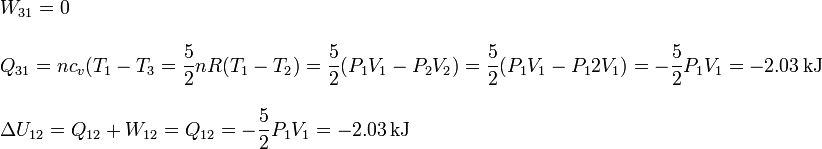
Podemos verificar que la suma de los calores, trabajos y variaciones de energía interna se corresponde con los resultados de los apartados anteriores.