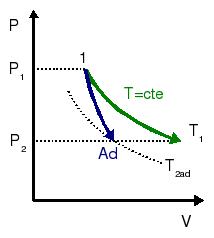
Comparación de un proceso isotérmico y uno adiabático
De Laplace
Contenido |
1 Enunciado
Un gas ideal monoatómico ocupa un volumen de 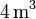 a la presión de
a la presión de 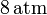 y a la temperatura de
y a la temperatura de
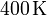 . El gas se expande hasta la presión final de
. El gas se expande hasta la presión final de
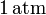 mediante un proceso cuasiestático. Calcule el
trabajo realizado, el calor absorbido y la variación de energía interna en
los siguientes casos:
mediante un proceso cuasiestático. Calcule el
trabajo realizado, el calor absorbido y la variación de energía interna en
los siguientes casos:
- Expansión isoterma.
- Expansión adiabática.
2 Solución
2.1 Expansión isoterma
La energía interna de un gas ideal sólo depende de su temperatura. Al ser un proceso isotermo, ésta no cambia. Por tanto
ΔU = 0
Para calcular el trabajo realizado utilizamos la ecuación de estado para expresar la presión en función del volumen
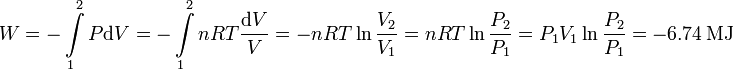
Hemos usado la ley de Boyle para expresar el resultado en función del cociente de presiones, y la ecuación del gas ideal para sustituir nRT por P1V1. El trabajo es negativo, pues al expandirse el gas realiza trabajo sobre el recipiente que le contiene.
Como la variación de energía interna es nula, el calor absorbido por el gas es
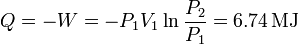
2.2 Expansión adiabática
En este caso el calor absorbido por el gas es cero:
Q = 0
Podemos expresar la variación de energía interna en función de la diferencia de temperaturas entre los estados inicial y final
ΔU = ncv(T2 − T1)
Aqui, cv es el calor específico molar a volumen constante. Para un gas ideal monoatómico tenemos cv = 3R / 2. Nos falta encontrar la temperatura en el estado final. Para ello usamos la ecuación de Poisson
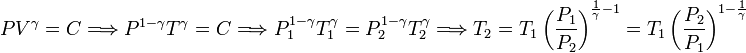
Por tanto, la variación de energía interna es
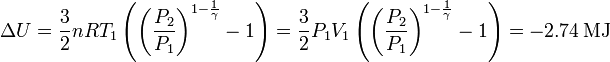
Hemos usado que en un gas monoatómico γ = 5 / 3. El trabajo que realiza el gas es
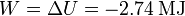
2.3 Comparación de los dos procesos
Podemos observar que el trabajo realizado por el gas en el proceso adiabático es menor que el que realiza en el proceso isotermo. Esto puede comprobarse también en el diagrama PV de la figura. En un punto del diagrama, la pendiente de la adiabática es siempre mayor que la de la isoterma. Entonces, al hacer la expansión, la adiabática se queda a la derecha de la isoterma, y por tanto, el área debajo de la adiabática es menor que debajo de la isoterma.