Obtención de las capacidades caloríficas de un gas, F2 GIA (Nov, 2012)
De Laplace
Contenido |
1 Enunciado
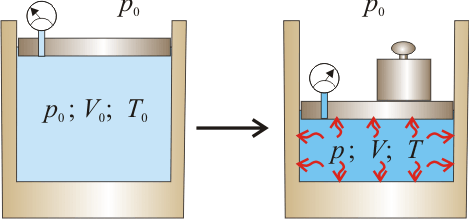
En el interior de un recipiente, cerrado mediante un pistón móvil, hay 4.48 litros de un gas ideal que inicialmente se encuentra a la presión de 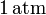 y
y 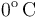 de temperatura. Las paredes del recipiente y el pistón pueden considerarse perfectamente impermeables al calor. Para determinar las características del gas se desplaza el pistón
de manera cuasiestática, comprimiendo aquél hasta que su volumen se reduce a la mitad del inicial. Se mide la presión y se comprueba que ésta es ahora
de temperatura. Las paredes del recipiente y el pistón pueden considerarse perfectamente impermeables al calor. Para determinar las características del gas se desplaza el pistón
de manera cuasiestática, comprimiendo aquél hasta que su volumen se reduce a la mitad del inicial. Se mide la presión y se comprueba que ésta es ahora 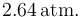
- ¿Cuál es el valor del coeficiente adiabático del gas? ¿Puede decir si se trata de un gas monoatómico o diatómico?
- Determine los valores de las capacidades caloríficas y los calores específicos molares del gas.
Dato: 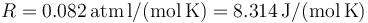
2 Solución
Comenzaremos determinar la masa de gas, teniendo en cuenta que se encuentra en condiciones de gas de ideal y que, en el proceso descrito, se halla en equilibrio en todo momento. Es decir, los valores de presión (P), volumen (V), temperatura (T, expresada en la escala absoluta) y el número de moles (n) del gas, deben verificar en todo momento la ecuación de los gases ideales. A partir de los datos del estado inicial, se obtiene...
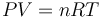

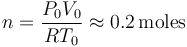
2.1 Obtención del coeficiente adiabático del gas
En el enunciado se nos indica que se comprime el gas hasta reducir su volumen a la mitad, siguiendo un proceso cuasi-estático que permite asegurar que el gas se encuentra siempre en equilibrio. Por otra parte se indica que las paredes del recipiente son impermeables al calor, por lo que dicho proceso se realiza adiabáticamente: sin intercambiar con el medio energía en forma de calor. En estas condiciones, los valores de presión y volumen del gas durante el proceso adiabático deben verificar la ecuación:
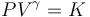
donde γ es el coeficiente adiabático a determinar, y K, un valor constante fijado por las condiciones iniciales. Los valores de presión y volumen en los estados inicial y final debens ser tales que

Tomando logaritmos en este expresión y sustituyendo los valores conocidos de presión y volumen en los estados inicial y final, se obtiene...
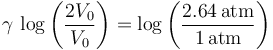

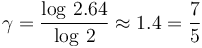
Se trata, por tanto, de un gas ideal diatómico.
2.2 Capacidades caloríficas y calores específicos molares
La ley de Mayer establece que, en un gas ideal, la diferencia entre los valores de los calores específicos molares a presión y a volumen constante, es igual a la constante de los gases ideales, R.
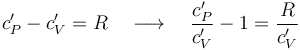
Por otra parte, el cociente entre los calores específicos a presión y a volumen constante es, por definición, el coeficiente adiabático γ. En consecuencia, el gas diatómico del sistema bajo estudio verificará:
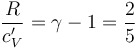

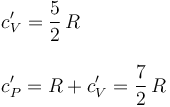
La capacidad calorífica de la cantidad de gas encerrado en el recipiente adiabático será: