Energía interna, calor y trabajo en proceso cíclico, F2 GIA (Jun, 2013)
De Laplace
Contenido |
1 Enunciado
Una cierta cantidad de gas monoatómico ideal contenida en un recipiente hermético realiza el proceso cíclico representado en el diagrama P − V de la figura y que se describe a continuación:
En el estado inicial de equilibrio “A” ocupa un volumen V0, a una presión P0, en equilibrio térmico con un entorno que se encuentra a una temperatura T0. En primer lugar, el sistema experimenta una compresión isoterma “1”, por el cuál el gas reduce su volumen a la mitad del valor inicial, pero manteniendo constante la temperatura T0. Una vez alcanzado el estado “B”, el sistema verifica una expansión isóbara “2” (a presión constante) hasta el estado “C”, para recuperar el volumen V0 del estado inicial. Finalmente, en un último proceso isócoro “3” (a volumen constante), se reduce la presión del sistema hasta el valor inicial P0, alcanzando de nuevo el estado “A”. El proceso cíclico se realiza de manera que pueda considerarse que el gas se encuentra, en todo momento, en equilibrio termodinámico.- De manera razonada y sin necesidad de realizar cálculos, qué puede decir acerca de las variaciones de energía interna en cada uno de los tres procesos parciales que constituyen el proceso cíclico descrito.
- Determine los valores de presión, volumen y temperatura del sistema en los estados “B” y “C”, en función de los valores iniciales.
- Para cada uno de los procesos parciales, indique de manera razonada el “sentido” en que se verifican las transferencias de calor y trabajo. Indique, asimismo, cómo es la transferencia neta de calor y trabajo en el proceso completo.
- Calcule el rendimiento del ciclo, definido como la relación entre el trabajo neto (en valor absoluto) transferido en el proceso cíclico, y la cantidad de calor absorbido Qin (es decir, sólo el que entra en el sistema).
2 Solución
2.1 Variaciones de energía interna
Un sistema termodinámico realiza un proceso cíclico cuando partiendo de un determinado estado, sufre una serie de transformaciones para terminar en el mismo estado termodinámico inicial. Por tanto se tendrá que, en este tipo de procesos, la variación total de la energía interna del sistema es nula, al ser ésta una función de estado:

Por otra parte, todo proceso cíclico puede considerarse como la yuxtaposición de varios subprocesos no cíclicos; por ejemplo, en el caso bajo estudio sería los proceso “1”, “2” y “3”, descritos en el enunciado. De la propia definición de energía interna se induce que la variación de energía interna en el proceso cíclico es igual a la suma de la variaciones U(i)verificadas por dicha magnitud termodinámica en cada uno de los subprocesos; en virtud de la consdieración anterior, se tendrá que dicha suma ha de ser nula:

En el enunciado se indica que el sistema termodinámico que realiza el proceso bajo estudio es puede considerarse como un gas ideal que se halla en un recipiente cerrado. Como se sabe, la energía interna de este tipo de sistema depende exclusivamente de su temperatura, y que la capacidadad calorífica del gas a volumen constante,  , es el coeficiente (constante) que determina la variación de la energía interna por unidad de temperatura. Obsérvese que el proceso “1” es isotermo; es decir, se verifica siempre a un valor constante de temperatura, T0, por lo que no habrá variación de la energía interna.
, es el coeficiente (constante) que determina la variación de la energía interna por unidad de temperatura. Obsérvese que el proceso “1” es isotermo; es decir, se verifica siempre a un valor constante de temperatura, T0, por lo que no habrá variación de la energía interna.



En los procesos “2” y “3” sí habrá variación de energía interna, pues en ambos cambia la temperatura del gas. Sin embargo, podemos asegurar que las variaciones sufridas por esta propiedad termodinámica en ambos procesos deben ser opuestas:


2.2 Valores de presión, volumen y temperatura
En el estado inicial “A”, la presión, el volumen y la temperatura de los n moles de gas que constituyen el sistema, tienen sendos valores conocidos:

Como se trata de un estado de equilibrio, dichos valores verificarán la ecuación de estado de los gases ideales:
![f(n,P,V,T)\big|_\mathrm{A}=\big[P\!\ V-n\!\ R\!\ T\big]_\mathrm{A}=0\qquad\Longrightarrow\qquad\frac{P_0V_0}{T_0}=n\!\ R](/wiki/images/math/3/5/0/3508df7b327da8d70b66b143a88fd801.png)
donde  , es la constante de los gases ideales, expresada en unidades del SI. En el estado “B”, también de equilibrio, se conocen los valores de volumen y temperatura. La presión se obtiene al tener en cuenta que dichos valores deben verificar tambien la ecuación de estado:
, es la constante de los gases ideales, expresada en unidades del SI. En el estado “B”, también de equilibrio, se conocen los valores de volumen y temperatura. La presión se obtiene al tener en cuenta que dichos valores deben verificar tambien la ecuación de estado:
![\left.\begin{array}{l}\displaystyle V\big|_\mathrm{B}=\frac{V_0}{2}\,\mathrm{;}\,\quad T\big|_\mathrm{B}=T_0\\ \\ \displaystyle \big[P\!\ V-n\!\ R\!\ T\big]_\mathrm{B}=0\end{array}\right\}](/wiki/images/math/f/6/d/f6d24b6a0172b006c9dfe8811ac1aae1.png)


El sistema llega al estado de equilibrio “C” desde el “B” al recuperar el volumen inicial, siguiendo un proceso a presión constante. Se tendrá, por tanto:
![\left.\begin{array}{l}\displaystyle V\big|_\mathrm{C}=V_0\,\mathrm{;}\,\quad P\big|_\mathrm{C}=P\big|_\mathrm{B}=2\!\ P_0\\ \\ \displaystyle \big[P\!\ V-n\!\ R\!\ T\big]_\mathrm{C}=0\end{array}\right\}](/wiki/images/math/b/b/8/bb878d198e8a3d0e8ba2741af7bb52c7.png)


2.3 Transferencias de calor y trabajo
2.3.1 En la compresión isoterma “1”
El proceso “1” consiste en una compresión isoterma del sistema, lo cual implica una reducción de su volumen y, en consecuencia, que la energía transferida al sistema en forma de trabajo es positiva:



Es decir, se trata de un trabajo que el entorno realiza sobre el sistema. Y si aplicamos el Primer Principio de la Termodinámica a este proceso, en el cuál la energía interna del gas permanece invariable, llegamos a la conclusión de que la energía transferida al sistema en forma de calor debe ser opuesta al trabajo:



Es decir, en la compresión isoterma “1” el entorno realiza trabajo sobre el sistema, transfiriéndole energía; sin embargo, el sistema cede esa misma cantidad de energía al entorno en forma de calor, de manera que aquél mantiene constantes su energía interna y, por tanto, su temperatura al ser un gas ideal. Las cantidades de energía transferidas en uno y otro sentido podemos determinarlas evaluando el trabajo realizado sobre el sistema. Como el gas realiza el proceso isotermo de manera que siempre se halla en equilibrio, las variables termodinámicas verificarán en todo momento la ecuación de estado:


2.3.2 En la expansión isóbara “2”
Este proceso se caracteriza por que en, todo momento, el gas ideal permanece a presión constante, cuyo valor fue calculado en el apartado 2.2. Si además se trata de un proceso reversible, todos los estados del gas durante dicho proceso son de equilibrio, por lo que los valores del volumne y la temperatura del gas, deben verificar la ecuación de estado de los gases ideales, para dicho valor de presión constante:

La energía transferida al sistema en forma de trabajo termodinámico, en cada paso, y en el proceso completo es:



Como es bien sabido, el signo negativo del trabajo indica que el sistema realiza trabajo sobre el entorno, perdiendo energía. Por su parte, el calor transferido al gas en cada pasao del proceso isóbaro (a presión constante), es proporcional a la variación de temperatura, siendo la capacidad calorífica a presión constante, CP, la constante de proporcionalidad. Al ser el proceso reversible, los cambios de temperatura y volumen del sistema deben ser tales que en todo momento se verifique la ecuación de estado; es decir:

donde 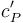 es el calor específico molar del gas, a presión constante. Como se trata de un gas monoatómico en condiciones de gas ideal, dicho coeficiente tiene un valor
es el calor específico molar del gas, a presión constante. Como se trata de un gas monoatómico en condiciones de gas ideal, dicho coeficiente tiene un valor  , por lo que la energía transferida al sistema en forma de calor durante esta expansión es:
, por lo que la energía transferida al sistema en forma de calor durante esta expansión es:

Puede comprobarse que este mismo resultado se obtiene integrando directamente en la expresión del calor transferido y sustituyendo los resultados de los valores de presiones, volúmenes y temperaturas obtenidos en el apartado anterior:

La variación de energía interna sufrida por el gas en este segundo proceso es igual a la suma de toda la energía (calor y trabajo) transferida al sistema durante el mismo:

2.3.3 En el proceso isócoro “3”
Este proceso se caracteriza porque el volumen del gas entre los estados C y A, permanece con un valor constante V0. Si además se trata de un proceso reversible consistente en una sucesión de estados de equilibrio, se tendrá que las expresiones características de dicho proceso son:

Como no hay variación del volumen, en un proceso de este tipo no hay transferencia de energía en forma de trabajo termodinámico:



Para determinar el calor transferido en este proceso podemos seguir varios procedimientos; por ejemplo, calcularlo por integración directa teniendo en cuenta que se trata de un proceso a volumen constante de un gas monoatómico, y que conocemos los valores de las temperaturas en los estados inicial (C) y final (A):



Este mismo resultado puede obtenerse aplicando resultados obtenidos anteriormente: como no hay transferencia de energía en forma de trabajo termodinámico, la variación de energía interna entre los estados C y A coincide con el calor tranferido en este proceso isócoro; por otra parte, en el apartado 2.1 se obtuvo que las variaciones de energía interna en los procesos “2” y “3” son opuestas:

Otra posibilidad habría sido expresar el elemento de calor transferido,  , en términos de la variación de la presión, dP, e integrar entre los valores inicial 2P0, y final P0.
, en términos de la variación de la presión, dP, e integrar entre los valores inicial 2P0, y final P0.
2.4 Rendimiento del ciclo
Evaluemos las cantidades totales de energía transferidas al sistema. En forma de trabajo...



Es decir, cada vez que se completa un ciclo, el sistema ha realizado un trabajo neto sobre el entorno:

El carácter cíclico del proceso completo y el Primer Principio de la Termodinámica permite concluir que el calor total transferido, es opuesto al trabajo. Sin embargo, nos interesa distinguir entre los calores absorbidos (Qin > 0), y cedidos (Qout > 0) por el sistema durante el ciclo:



Obsérvese que el resultado del proceso cíclico es que le sistema absorbe una cantidad de calor mayor que la que cede (en valor absoluto); la diferencia entre estas cantidades de calor es igual a la cantidad de trabajo realizada en cada ciclo:

Se tiene entonces que el gas ideal bajo estudio, realizando el proceso cíclico descrito, constituye una máquina térmica que en cada ciclo adquiere energía neta en forma de calor y la devuelve al entorno en forma de trabajo. El rendimiento de esta máquina se define como la relación entre el trabajo neto realizado en cada ciclo y la cantidad de energía que absorve en forma de calor:

Nótese que, desde el punto de vista del funcionamentieno de la máquina térmica, el calor cedido por el sistema al entorno en el ciclo ( ), se considera energía perdida o no aprovechada en el proceso.
), se considera energía perdida o no aprovechada en el proceso.






