Proceso isotermo y adiabático consecutivos
De Laplace
Contenido |
1 Enunciado
Se comprime un mol de aire en condiciones estándar mediante un proceso isotermo hasta reducir su volumen a la mitad, luego se expande adiabáticamente hasta recuperar su presión inicial. Ambos procesos son cuasiestáticos. Halle
- La temperatura final
- El trabajo total realizado por el gas
- El calor total absorbido por el gas
- La variación de energía interna
2 Introducción
El gráfico representa los dos procesos a los que se somete el gas, primero una compresión isoterma y después una expansión adiabática. Analicemos cada uno de estos procesos
3 Compresión isoterma
Los datos que tenemos de este proceso son
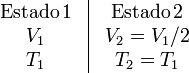
Al ser isotermo la variación de energía interna del gas es nula
ΔU12 = 0
El trabajo realizado es
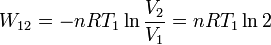
Y el calor absorbido es
Q12 = − W12 = nRT1ln2
4 Expansión adiabática
El proceso viene descrito por los parámetros
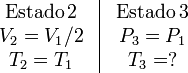
Podemos determinar P2 usando la ley de Boyle para relacionar los estados 1 y 2
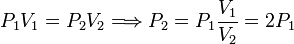
Y ahora usamos la ecuación de Poisson para relacionar los estados 2 y 3
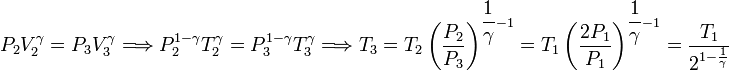
En el proceso adiabático se cumple
Q23 = 0
La variación de energía interna es
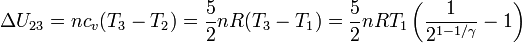
Hemos usado que el aire se puede considerar un gas ideal diatómico, y por tanto, cv = 5R / 2. Al ser adiabático, el trabajo en el proceso es
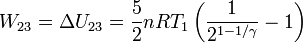
5 Proceso completo
Las cantidades pedidas en el proceso completo son
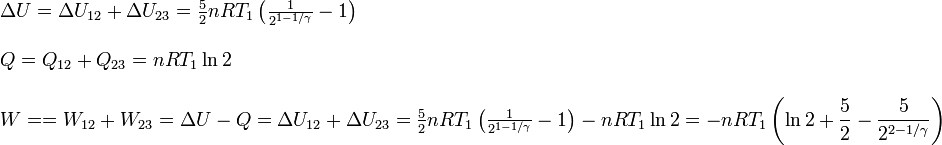
6 Posición del estado 3 en el diagrama PV
Vamos a determinar la posición del estado 3 en el diagrama, teniendo en cuenta que γ > 1. Tenemos
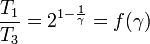
La función f(γ) es monótona creciente en el intervalo
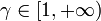 , pues
, pues
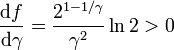
en ese intervalo. Además tenemos

Por tanto, se cumple
T3 < T1
De una manera similar podemos concluir que
V2 < V3 < V1
Esos valores corresponden a la posición del estado 3 que podemos ver en la representación del proceso en el diagrama PV. La pendiente de la adiabática es mayor que la de la isoterma, por lo que al expandirse el gas dejamos la isoterma a la izquierda de la adiabática. Ahora podemos concluir que el trabajo total realizado por el gas es negativo, pues el área bajo la isoterma es mayor que el área bajo la adiabática






