Problemas de calor y trabajo (GIA)
De Laplace
Contenido |
1 Problemas del boletín
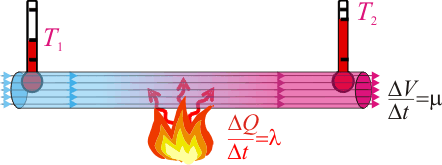
1.1 Tubería calentada con líquido fluyendo en su interior
Por una tubería calentada en su punto medio con una llama invariable fluyen 50 l de agua por segundo. La temperatura de entrada es de 20 °C, y la de salida de 35 °C. Otro líquido de densidad 0.8, circula a continuación por el mismo tubo calentado por la misma llama, pero con un caudal de 25 l/s. Las temperaturas en los dos extremos se estacionan ahora en 18 °C y en 68 °C. Calcular el calor específico del líquido.1.2 Temperatura de una llama
Para averiguar la temperatura de una llama se calienta con ella un trozo de hierro de 200 g que, a continuación, se introduce en un calorímetro que contiene un litro de agua. Se observa que la temperatura de ésta aumenta de 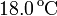 a
a 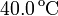 . ¿Cuál es la temperatura de la llama?
. ¿Cuál es la temperatura de la llama?
Datos: capacidad calorífica del calorímetro, 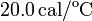 ; calor específico del hierro,
; calor específico del hierro, 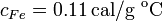 ; calor específico del agua líquida,
; calor específico del agua líquida, 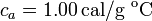 .
.
1.3 Estado final de hielo mezclado con vapor de agua
Un calorímetro, cuya capacidad calorífica es 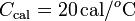 , se encuentra en equilibrio térmico con
, se encuentra en equilibrio térmico con 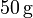 de hielo a
de hielo a 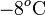 que contiene en su interior. Si se introducen
que contiene en su interior. Si se introducen 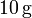 de vapor de agua a 100oC, ¿cuál será la temperatura final de la mezcla cuando se vuelva a recuperar el equilibrio térmico?
de vapor de agua a 100oC, ¿cuál será la temperatura final de la mezcla cuando se vuelva a recuperar el equilibrio térmico?
Datos: calor específico del agua, 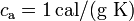 ; calor específico del hielo,
; calor específico del hielo, 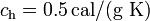 ; calor latente de fusión del hielo,
; calor latente de fusión del hielo, 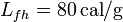 ; calor latente de vaporización del agua,
; calor latente de vaporización del agua, 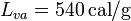 .
.
1.4 Enfriado de agua mediante hielo
Para enfriar un litro de agua que está a 20°C se le añaden 250 gramos de hielo a -4°C. Determinar el estado final de la mezcla supuestas despreciables las pérdidas de calor.
Datos: calor específico del agua, 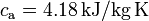 ; calor específico del hielo,
; calor específico del hielo, 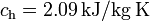 ; calor latente de fusión del hielo,
; calor latente de fusión del hielo, 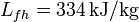 .
.
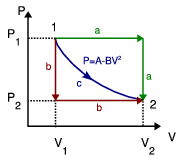
1.5 Trabajo en tres procesos que unen dos estados
Calcula el trabajo realizado sobre un fluido que se expande en los tres procesos entre los mismos estados inicial y final indicados en la figura. En el proceso c, que es cuasi-estático, se tiene 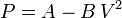 , con
, con 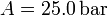 y
y 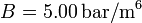 . Los volúmenes inicial y final son
. Los volúmenes inicial y final son 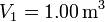 y
y 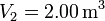 .
.
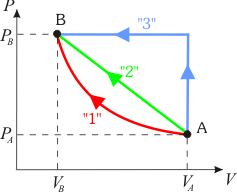
1.6 Comparación de calores transferidos en tres procesos cuasiestáticos
En la figura adjunta se muestran representados en un diagrama PV tres procesos termodinámicos cuasiestáticos distintos que han tenido lugar en un mismo sistema de gas ideal. Los tres procesos parten del mismo estado inicial A, y terminan en un idéntico estado final B. ¿En cuál de ellos es mayor la cantidad de calor transferida al sistema?2 Otros problemas
2.1 Medida de la temperatura de un vaso
Se quiere determinar la temperatura de un vaso metálico. Para ello, se vierte en él cierto volumen de agua fría a 12 °C y se mide la temperatura de equilibrio, que resulta ser de 20 °C. Se añade un segundo volumen de agua fría igual al primero y se mide la nueva temperatura de equilibrio de 18 °C. ¿Cuál era la temperatura inicial del vaso metálico?
2.2 Inmersión de bloque metálico en mezcla de agua y hielo
Un calorímetro contiene 500 g de agua y 300 g de hielo, todo ello a una temperatura de 0 °C. Se coge un bloque metálico de 1000 g de un horno cuya temperatura es de 240 °C y se deja caer rápidamente dentro del calorímetro, resultando que se produce exactamente la fusión de todo el hielo. ¿Cuál sería la temperatura final del sistema si la masa de hierro fuese el doble? Desprecia las pérdidas caloríficas del calorímetro y su capacidad calorífica.
2.3 Estado final de una mezcla de hielo y vapor de agua
En un calorímetro que contiene 200 g de hielo a -8.00 °C se introducen 50.0 g de vapor de agua a 100 °C. El equivalente en agua del calorímetro es 20.0 g. Determina el estado final de la mezcla.
Datos: calor específico del hielo, 0.500 cal/g °C; calor latente de fusión del hielo, 80.0 cal/g; calor latente de vaporización del agua, 537 cal/g.
2.4 Otra mezcla más de hielo y vapor
Un calorímetro, cuya capacidad calorífica (o equivalente en agua) es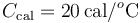 , se encuentra en equilibrio térmico con
, se encuentra en equilibrio térmico con 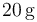 de hielo a
de hielo a 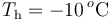 que contiene en su interior. Se introducen
que contiene en su interior. Se introducen 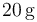 de vapor de agua a
de vapor de agua a 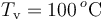 , provocando un desequilibrio en el sistema. Determine el estado final de la mezcla (temperatura y cantidades de agua líquida, hielo y vapor) cuando se recupera el equilibrio térmico, sabiendo que en todo momento se mantiene una presión de 1 atmósfera.
, provocando un desequilibrio en el sistema. Determine el estado final de la mezcla (temperatura y cantidades de agua líquida, hielo y vapor) cuando se recupera el equilibrio térmico, sabiendo que en todo momento se mantiene una presión de 1 atmósfera.
Datos: calor específico del agua, 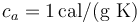 ; calor específico del hielo,
; calor específico del hielo, 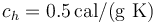 ; calor latente de fusión del hielo,
; calor latente de fusión del hielo,
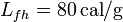 ; calor latente de vaporización del agua,
; calor latente de vaporización del agua, 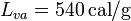 .
.
2.5 Fusión de hielo por disminución de energía potencial gravitatoria
Un bloque de hielo a 0°C se deja caer libremente desde una altura de 80 m. En el momento del choque, un 20% de la energía del bloque se transforma en calor absorbible por su masa. ¿Que parte del hielo se funde a causa de esta absorción?