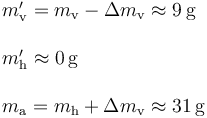Estado final de una mezcla: aplicación, F2 GIA (Sept, 2012)
De Laplace
Contenido |
1 Enunciado
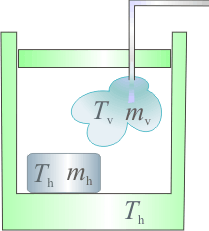
Un calorímetro, cuya capacidad calorífica (o equivalente en agua) es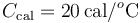 , se encuentra en equilibrio térmico con
, se encuentra en equilibrio térmico con 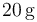 de hielo a
de hielo a 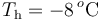 que contiene en su interior. Se introducen
que contiene en su interior. Se introducen 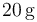 de vapor de agua a
de vapor de agua a 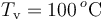 , provocando un desequilibrio en el sistema. Determine el estado final de la mezcla (temperatura y cantidades de agua líquida, hielo y vapor) cuando se recupera el equilibrio térmico, sabiendo que en todo momento se mantiene una presión de 1 atmósfera.
, provocando un desequilibrio en el sistema. Determine el estado final de la mezcla (temperatura y cantidades de agua líquida, hielo y vapor) cuando se recupera el equilibrio térmico, sabiendo que en todo momento se mantiene una presión de 1 atmósfera.
Datos: calor específico del agua, 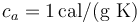 ; calor específico del hielo,
; calor específico del hielo, 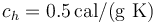 ; calor latente de fusión del hielo,
; calor latente de fusión del hielo,
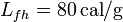 ; calor latente de vaporización del agua,
; calor latente de vaporización del agua, 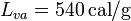 .
.
2 Solución
El estado físico de la mezcla, tras recuperarse el equilibrio térmico en el sistema, va a depender de su temperatura final.
2.1 Hipótesis A
Establezcamos como primera hipótesis que las masas de hielo y vapor se habrán convertido por completo en agua líquida. Puesto que la presión en todo instante es de una atmósfera, esto implicaría que la temperatura final T de la mezcla se ha de encontrar entre los valores correspondientes a las temperaturas de fusión (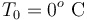 ) y de vaporización (
) y de vaporización (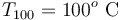 ) del agua a dicha presión.
) del agua a dicha presión.
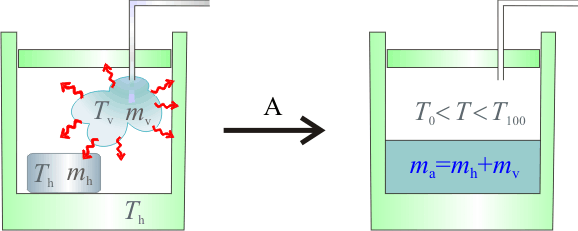
Como la temperatura inicial de la masa de vapor es Tv = T100, la cantidad de calor cedido por la masa de vapor será igual al necesario para cambiar de estado a 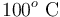 , más la que pierde al descender su temperatura, ya como agua líquida, hasta el valor final T de la mezcla:
, más la que pierde al descender su temperatura, ya como agua líquida, hasta el valor final T de la mezcla:
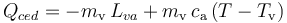
Esta cantidad de calor, desconocida a priori no se conoce la temperatura final T de la mezcla y del calorímetro, se empleará en aumentar la temperatura de éste desde su valor inicial Th, así como para calentar y fundir la masa de hielo, y aumentar la temperatura de la masa de agua líquida resultante hasta el valor de equilibrio T. Estos procesos implican una cantida de calor absorbido:
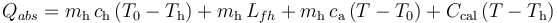
Para determinar el valor de T basta con exigir que la suma de las cantidades de calor cedido y absorbido en el sistema debe ser nula. Para expresar correctamente dicho valor en la escala Celsius, tomamos como referencia el valor correspondiente a la temperatura de fusión del agua a una atmósfera de presión, 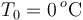 , de manera que:
, de manera que:
![\left.\begin{array}{l}\displaystyle T-T_\mathrm{v}=T-T_0+T_0-T_\mathrm{v}\\ \\ \displaystyle T-T_\mathrm{h}=T-T_0+T_0-T_\mathrm{h}\end{array}\right\}\;\longrightarrow\; \left\{ \begin{array}{lcl} Q_{abs}+Q_{ced}&=&\big(m_\mathrm{h}\!\ c_\mathrm{h}+C_\mathrm{cal}\big)\!\ (T_0-T_\mathrm{h})+m_\mathrm{h}\!\ L_{fh}+\big[(m_\mathrm{h}+m_\mathrm{v})\!\ c_\mathrm{a}+C_\mathrm{cal}\big]\!\ (T-T_0)-\\ & & \\ &{} & -m_\mathrm{v}\!\ L_{va}-m_\mathrm{v}\!\ c_\mathrm{a}\!\ (T_\mathrm{v}-T_0)=0\end{array}\right.](/wiki/images/math/1/0/e/10e63f99e385c00ca0825a8b42cd8d2a.png)
Reordenando los términos de esta ecuación y sutituyendo los datos conocidos de masas, calores específicos e incrementos de temeperatura, se obtiene:
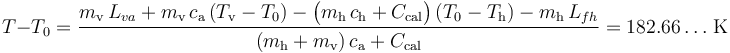



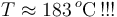
Obsérvese que este valor es superior al de la temperatura de vaporización del agua contraviniendo, por tanto, la hipótesis de que toda la masa de hielo y de vapor se han convertido en agua líquida. En consecuencia, hemos de deshechar este resultado y plantear otras hipótesis que nos permitan llegar a resultados coherentes con ellas.
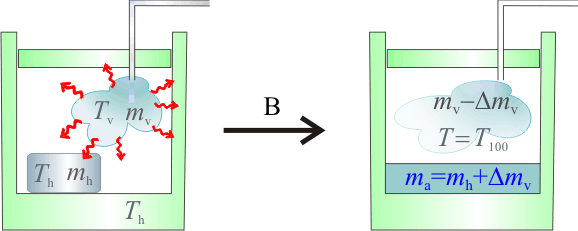
2.2 Hipótesis B
La única hipótesis descartable a priori es que coexistan tanto hielo, como agua líquida y vapor de agua, pues esto sólo sería posible a una presión mucho menor que una atmósfera. Dado que las masas de hielo y vapor son iguales, a priori parece bastante improbable que toda la masa de hielo acabe también vaporizándose, o que toda la masa de vapor acabe congelada. Así que, una vez descartadas éstas y la situación de la hipótesis A, quedan dos opciones: que en el estado final coexistan agua líquida y vapor, lo que implicaría que el valor final de la temperatura de equilibrio fuese 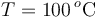 ; o que al recuperarse el equilibrio haya hielo y agua líquida, a una temperatura
; o que al recuperarse el equilibrio haya hielo y agua líquida, a una temperatura 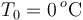 .
.
Y puesto que inicialmente hay igual cantidad de vapor y de hielo, y que el calor latente de vaporización es mucho mayor que el de fusión (casi unas siete veces), parece que lo más probable es que el calor cedido por cuando sólo se condensa una cierta cantidad de vapor, es suficiente para fundir todo el hielo y calentar la correspondiente cantidad de agua líquida (y el calorímetro) hasta la temperatura 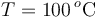 del estado final.
del estado final.
Como desconocemos la cantidad δmv que se condensa, tampoco conocemos el calor cedido por ese vapor:
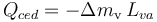
La cantidad de calor absorbido por la masa de hielo para aumentar su temperatura, fundirse y calentarse hasta 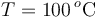 , y por el calorímetro es:
, y por el calorímetro es:
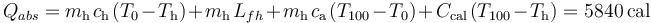
Exigiendo que las anteriores cantidades de calor deben ser opuestas, se obtiene la cantidad de vapor que se ha convertido en agua líquida:
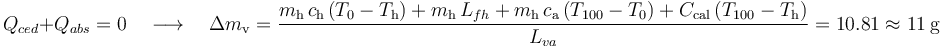
Que al ser una cantidad menor que la masa inicial de vapor, es compatible con la hipótesis formulada en este apartado. Por tanto, el estado final del sistema está caracterizado por los siguientes valores de temperatura y masa: