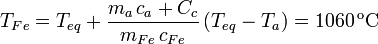Temperatura de una llama GIA
De Laplace
1 Enunciado
Para averiguar la temperatura de una llama se calienta con ella un trozo de hierro de 200 g que, a continuación, se introduce en un calorímetro que contiene un litro de agua. Se observa que la temperatura de ésta aumenta de 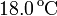 a
a 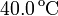 . ¿Cuál es la temperatura de la llama?
. ¿Cuál es la temperatura de la llama?
Datos: capacidad calorífica del calorímetro, 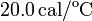 ; calor específico del hierro,
; calor específico del hierro, 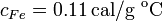 ; calor específico del agua líquida,
; calor específico del agua líquida, 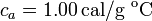 .
.
2 Solución
Al introducir el trozo de hierro en el calorímetro, como está a una temperatura mayor que el agua y el vaso, cede calor a éstos. El proceso continúa hasta que se alcanza una temperatura de equilibrio.
Hay tres sistemas que intercambiar calor: el trozo de hierro, el calorímetro y el agua. Veamos el calor que absorbe cada uno de ellos
Trozo de hierro: pasa de una temperatura TFe desconocida hasta la temperatura de equilibrio 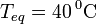
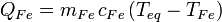
Agua: Pasa de la temperatura inicial 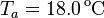 a la temperatura de equilibrio
a la temperatura de equilibrio
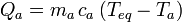
La masa de agua es 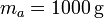 pues nos dicen que es un litro de agua.
pues nos dicen que es un litro de agua.
Calorímetro: Pasa de la temperatura inicial Ta a la temperatura de equilibrio Teq. El dato que nos dan es la capacidad calorífica del vaso.
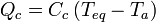
Como el sistema formado por el hierro, el agua y el vaso está aislado, la suma de calores transferidos entre ellos debe ser cero
QFe + Qa + Qc = 0
De aquí despejamos la temperatura de la llama, que es la temperatura inicial del hierro.