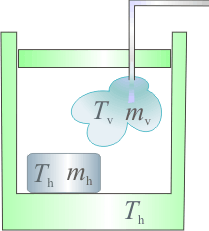
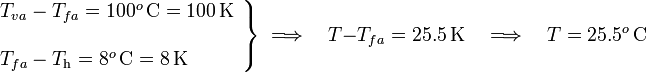Estado final de hielo mezclado con vapor de agua (F2GIA)
De Laplace
1 Enunciado
Un calorímetro, cuya capacidad calorífica es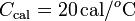 , se encuentra en equilibrio térmico con
, se encuentra en equilibrio térmico con 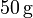 de hielo a
de hielo a 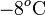 que contiene en su interior. Si se introducen
que contiene en su interior. Si se introducen 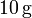 de vapor de agua a 100oC, ¿cuál será la temperatura final de la mezcla cuando se vuelva a recuperar el equilibrio térmico?
de vapor de agua a 100oC, ¿cuál será la temperatura final de la mezcla cuando se vuelva a recuperar el equilibrio térmico?
Datos: calor específico del agua, 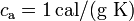 ; calor específico del hielo,
; calor específico del hielo, 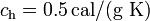 ; calor latente de fusión del hielo,
; calor latente de fusión del hielo, 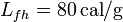 ; calor latente de vaporización del agua,
; calor latente de vaporización del agua, 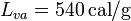 .
.
2 Solución
Planteamos la hipótesis de que la mezcla final estará a una temperatura final T, entre las de fusión y vaporización. En consecuencia, tanto la masa 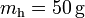 de hielo, como la
de hielo, como la 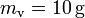 de vapor, se habrán convertido en agua en el estado final.
de vapor, se habrán convertido en agua en el estado final.
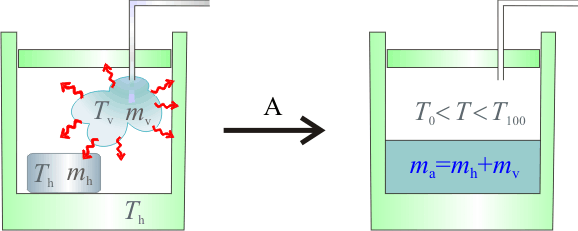
La masa inicial de vapor de agua habrá cedido una cantidad 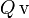 de calor en dos procesos: primero, para cambiar de estado y pasar a agua líquida a la temperatura de evaporación
de calor en dos procesos: primero, para cambiar de estado y pasar a agua líquida a la temperatura de evaporación 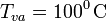 ; y después, al enfriarse hasta la temperatyra final T. En consecuencia, mientras que la primera de estas cantidades de calor transferido está perfectamente determinada al conocer la masa de vapor y el correspondiente calor latente, la segunda cantidad va a ser desconocida a priori:
; y después, al enfriarse hasta la temperatyra final T. En consecuencia, mientras que la primera de estas cantidades de calor transferido está perfectamente determinada al conocer la masa de vapor y el correspondiente calor latente, la segunda cantidad va a ser desconocida a priori:
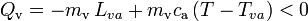
Obsérvese que, al tratarse de calor cedido por la masa de vapor, ambas cantidades parciales de calor transferido son negativas. Este calor será absorbido por los elementos del sistema que inicialmente se encontraban en equilibrio térmico a una temperatura 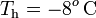 , inferior a la T final de la mezcla. En el caso del calor Qh absorbido por el hielo, se pueden distinguir tres cantidades parciales asociadas a otros tanto procesos. En primer lugar, la masa de hielo deberá aumentar su temperatura hasta el valor de fusión,
, inferior a la T final de la mezcla. En el caso del calor Qh absorbido por el hielo, se pueden distinguir tres cantidades parciales asociadas a otros tanto procesos. En primer lugar, la masa de hielo deberá aumentar su temperatura hasta el valor de fusión, 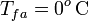 . Para calcular el valor absorvido en este proceso emplearemos el valor del calor específico del hielo. Después empleará calor absorbido para cambiar de estado, pasando a una masa mh de agua líquida a la temperatura de fusión. Finalmente, ésta absorberá calor (en función del calor específico del agua) para aumentar su temperatura hasta la T final de la mezcla:
. Para calcular el valor absorvido en este proceso emplearemos el valor del calor específico del hielo. Después empleará calor absorbido para cambiar de estado, pasando a una masa mh de agua líquida a la temperatura de fusión. Finalmente, ésta absorberá calor (en función del calor específico del agua) para aumentar su temperatura hasta la T final de la mezcla:
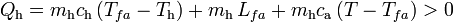
También será positiva la cantidad de calor transferida al calorímetro, para que pase de la temperatura inicial Th, hasta la final de la mezcla, T:
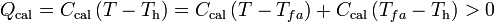
Aplicando ahora que las cantidad de calor cedidas y abosorbidas deben ser opuestas, se obtiene la ecuación que permite determinar la temperatura final:
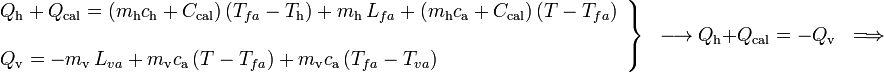
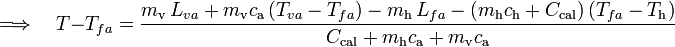
Y como el grado de la escala Celsius y el kelvin se correponden con el mismo incremento de temperatura, se tendrá...