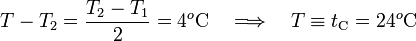Medida de la temperatura de un vaso GIA
De Laplace
Contenido |
1 Enunciado
Se quiere determinar la temperatura de un vaso metálico. Para ello, se vierte en él cierto volumen de agua fría a 12 °C y se mide la temperatura de equilibrio, que resulta ser de 20 °C. Se añade un segundo volumen de agua fría igual al primero y se mide la nueva temperatura de equilibrio de 18 °C. ¿Cuál era la temperatura inicial del vaso metálico?
2 Solución
En el ejercicio propuesto se tiene una recipiente o vaso, del cuál se desconocen los valores de su masa mv, calor específico cv, y temperatura inicial T. Como el objetivo es determinar esta última y la masa del vaso no va a cambiar, tomaremos como parámetro la capacidad calorífica Cv = mvcv del mismo. Por otra parte, para medir la temperatura del vaso se procede a vertir en su interior una cantidad indeterminada de agua, cuya capacidad calorífica Ca = maca también tendrá un valor desconocido.
La masa de agua está a una temperatura T1 que, en el escala Celsius, le corresponde un valor de 12°C. Como ésta será, en general, distinta de la temperatura T del vaso, se iniciará un proceso termodinámico (A), que culminará cuando la masa ma de agua y el vaso se encuentran en desequilibrio térmico. Consideraremos que en dicho proceso sólo va a tener valores significativos la transferencia de energía entre el vaso y la masa de agua, constituyendo ambos el universo observado.
2.1 Proceso A
Como el vaso es un sólido y el agua un fluido incompresible, la única forma posible de transferencia de energía será en forma de calor. Si T2 es la temperatura de equilibrio al final de este proceso (20°C en la escala Celsius), las cantidades de calor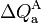 y
y 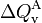 transferidas al agua y al vaso serán opuestas:
transferidas al agua y al vaso serán opuestas:

Por tanto, la variación sufrida por la temperatura del vaso en este proceso sera:
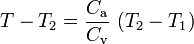
Sin embargo, en esta expresión se desconoce la relación entre las capacidades caloríficas del vaso y de la masa indeterminada de agua. Para ello, debemos realizar un segundo proceso, en el cual hemos de volver a usar una segunda cantidad de agua con igual valor de capaciadad calorífica Ca y, por tanto, con idéntica cantidad de masa ma. Si esta segunda masa de agua se halla también a 12°C (temperatura T1), se tendrá de nuevo un desequilibrio térmico, entre ésta y el vaso y el agua del proceso A. Se desencadena, por tanto, un segundo proceso B que finaliza cuando el vaso y la masa 2ma alcanzan la tempertura de equilibrio T3 (18°C en la escala Celsius).
2.2 Proceso B
La cantidad de calor transferida en este proceso al sistema, constituido por la segunda masa de agua fría (con igual capacidad calorífica que la primera), es:
Por su parte, la cantidad de calor transferida al entorno (es decir, al conjunto resultante al final del proceso A), será igual a la suma de los calores que se transfieren a la primera cantidad de agua y al vaso:

Exgiendo que los calores transferido a sistema y entorno deben ser opuestos, se obtiene:
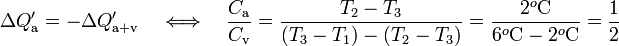
Y sustituyendo este resultado en la expresión del apartado anterior, obtenemos la medida en la escala Celsius de la temperatura inicial del vaso: