Problemas de procesos en gases ideales (GIA)
De Laplace
(→Trabajo en tres procesos que unen dos estados) |
(→Temperatura de una llama) |
||
| Línea 4: | Línea 4: | ||
== [[ Temperatura de una llama GIA | Temperatura de una llama ]] == | == [[ Temperatura de una llama GIA | Temperatura de una llama ]] == | ||
| + | Para averiguar la temperatura de una llama se calienta con ella un trozo de hierro de 200 g que, a continuación, se introduce en un calorímetro que contiene un litro de agua. Se observa que la temperatura de ésta aumenta de <math>18.0 </math> a <math>40.0\,\mathrm{^oC}</math>. ¿Cuál es la temperatura de la llama? | ||
| + | |||
| + | Datos: capacidad calorífica del calorímetro: <math>20.0\,\mathrm{cal/^oC}</math>, <math>c_{Fe}=0.11\,\mathrm{cal/g\cdot^oC}</math>, calor específico del agua líquida: <math>c_a=1.00\,\mathrm{cal/g^oC}</math>. | ||
== [[ Estado final de una mezcla de hielo y vapor de agua GIA | Estado final de una mezcla de hielo y vapor de agua ]] == | == [[ Estado final de una mezcla de hielo y vapor de agua GIA | Estado final de una mezcla de hielo y vapor de agua ]] == | ||
Revisión de 12:17 25 may 2011
1 Trabajo en tres procesos que unen dos estados
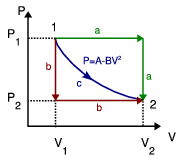
Calcula el trabajo realizado sobre un fluido que se expande en los tres procesos entre los mismos estados inicial y final indicados en la figura. En el proceso c, que es cuasi-estático, se tiene 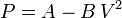 , con
, con 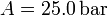 y
y 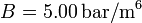 . Los volúmenes inicial y final son
. Los volúmenes inicial y final son 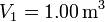 y
y 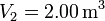 .
.
2 Temperatura de una llama
Para averiguar la temperatura de una llama se calienta con ella un trozo de hierro de 200 g que, a continuación, se introduce en un calorímetro que contiene un litro de agua. Se observa que la temperatura de ésta aumenta de 18.0 a 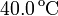 . ¿Cuál es la temperatura de la llama?
. ¿Cuál es la temperatura de la llama?
Datos: capacidad calorífica del calorímetro: 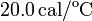 ,
, 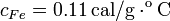 , calor específico del agua líquida:
, calor específico del agua líquida: 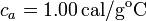 .
.
3 Estado final de una mezcla de hielo y vapor de agua
En un calorímetro que contiene 200 g de hielo a -8.00 °C se introducen 50.0 g de vapor de agua a 100 °C. El equivalente en agua del calorímetro es 20.0 g. Determina el estado final de la mezcla.
Datos: calor específico del hielo: 0.500 cal/g °C; entalpía de fusión del hielo: 80.0cal/g; entalpía de vaporización del agua: 537 cal/g