Problemas de gases ideales en equilibrio (GIA)
De Laplace
(Diferencias entre revisiones)
(→Presión en un neumático) |
(→Procesos de un gas ideal en diagramas) |
||
| Línea 9: | Línea 9: | ||
#Después de hacer circular el coche a gran velocidad, la temperatura en el interior del neumático aumenta hasta 85.0<math>\,\mathrm{^oC}</math> y su volumen aumenta en un 2.00%. ¿Cuál es la nueva presión (absoluta) del neumático expresada en pascales? | #Después de hacer circular el coche a gran velocidad, la temperatura en el interior del neumático aumenta hasta 85.0<math>\,\mathrm{^oC}</math> y su volumen aumenta en un 2.00%. ¿Cuál es la nueva presión (absoluta) del neumático expresada en pascales? | ||
| - | ==[[ Procesos de un gas ideal en diagramas GIA | | + | ==[[Cambios_de_presión,_volumen_y_temperatura_en_gas_ideal_(F2GIA)|Cambios de presión, volumen y temperatura en gas ideal]]== |
| + | |||
| + | |||
| + | ==[[ Procesos de un gas ideal en diagramas GIA | Cambios en el estado de un gas ideal]]== | ||
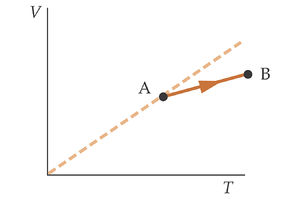
La figura de la izquierda muestra en un diagrama V-T un proceso realizado por una cantidad fija de un gas ideal. El gas pasa del estado A al estado B. ¿Qué ocurre con la presión del gas? | La figura de la izquierda muestra en un diagrama V-T un proceso realizado por una cantidad fija de un gas ideal. El gas pasa del estado A al estado B. ¿Qué ocurre con la presión del gas? | ||
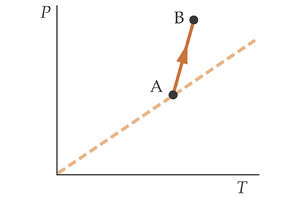
En la segunda gráfica tenemos otro proceso descrito por el gas en un diagrama P-T. ¿Qué ocurre en este caso con el volumen del gas? | En la segunda gráfica tenemos otro proceso descrito por el gas en un diagrama P-T. ¿Qué ocurre en este caso con el volumen del gas? | ||
[[Imagen:F2_GIA_Conceptos_diagrama_VT.jpg|300px]][[Imagen:F2_GIA_Conceptos_diagrama_PT.jpg|300px]] | [[Imagen:F2_GIA_Conceptos_diagrama_VT.jpg|300px]][[Imagen:F2_GIA_Conceptos_diagrama_PT.jpg|300px]] | ||
Revisión de 22:45 13 may 2013
Contenido |
1 Volumen y número de moléculas de un gas
Utilizando la ecuación de estado de los gases ideales, responde a las siguientes preguntas
- ¿Qué volumen ocupa un mol de gas en condiciones estándar?
- ¿Cuantas moléculas hay en
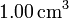 de gas ideal a una temperatura de
de gas ideal a una temperatura de 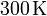 y a un presión de
y a un presión de 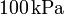 ? ¿Y si la presión es de
? ¿Y si la presión es de 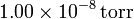 ?.
?.
2 Presión en un neumático
Un neumático de un automóvil se infla con aire que inicialmente se encuentra a una temperatura de 10.0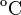 y a presión atmosférica normal. Durante el proceso, el aire se comprime hasta alcanzar el 28.0% de su volumen original, lo que hace que aumente su temperatura a 40.0
y a presión atmosférica normal. Durante el proceso, el aire se comprime hasta alcanzar el 28.0% de su volumen original, lo que hace que aumente su temperatura a 40.0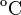
- ¿Cuál es la presión en el neumático?
- Después de hacer circular el coche a gran velocidad, la temperatura en el interior del neumático aumenta hasta 85.0
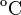 y su volumen aumenta en un 2.00%. ¿Cuál es la nueva presión (absoluta) del neumático expresada en pascales?
y su volumen aumenta en un 2.00%. ¿Cuál es la nueva presión (absoluta) del neumático expresada en pascales?
3 Cambios de presión, volumen y temperatura en gas ideal
4 Cambios en el estado de un gas ideal
La figura de la izquierda muestra en un diagrama V-T un proceso realizado por una cantidad fija de un gas ideal. El gas pasa del estado A al estado B. ¿Qué ocurre con la presión del gas?
En la segunda gráfica tenemos otro proceso descrito por el gas en un diagrama P-T. ¿Qué ocurre en este caso con el volumen del gas?