Problemas de gases ideales en equilibrio (GIA)
De Laplace
Contenido |
1 Volumen y número de moléculas de un gas
Utilizando la ecuación de estado de los gases ideales, responde a las siguientes preguntas
- ¿Qué volumen ocupa un mol de gas en condiciones estándar?
- ¿Cuantas moléculas hay en
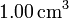 de gas ideal a una temperatura de
de gas ideal a una temperatura de 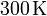 y a un presión de
y a un presión de 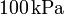 ? ¿Y si la presión es de
? ¿Y si la presión es de 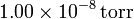 ?.
?.
2 Presión en un neumático
Un neumático de un automóvil se infla con aire que inicialmente se encuentra a una temperatura de 10.0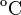 y a presión atmosférica normal. Durante el proceso, el aire se comprime hasta alcanzar el 28.0% de su volumen original, lo que hace que aumente su temperatura a 40.0
y a presión atmosférica normal. Durante el proceso, el aire se comprime hasta alcanzar el 28.0% de su volumen original, lo que hace que aumente su temperatura a 40.0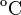
- ¿Cuál es la presión en el neumático?
- Después de hacer circular el coche a gran velocidad, la temperatura en el interior del neumático aumenta hasta 85.0
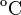 y su volumen aumenta en un 2.00%. ¿Cuál es la nueva presión (absoluta) del neumático expresada en pascales?
y su volumen aumenta en un 2.00%. ¿Cuál es la nueva presión (absoluta) del neumático expresada en pascales?
3 Cambios en el estado de un gas ideal
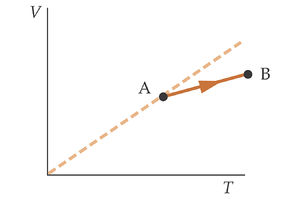
La figura de la izquierda muestra en un diagrama V-T un proceso realizado por una cantidad fija de un gas ideal. El gas pasa del estado A al estado B. ¿Qué ocurre con la presión del gas?
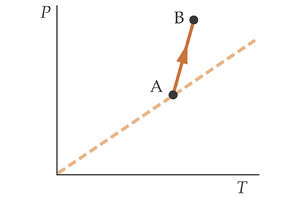
En la segunda gráfica tenemos otro proceso descrito por el gas en un diagrama P-T. ¿Qué ocurre en este caso con el volumen del gas?
4 Cambios de presión, volumen y temperatura en gas ideal
Cierto gas ideal constituye un sistema termodinámico (supuestamente cerrado) que evoluciona desde un estado inicial a otro final. Tras el proceso, se comprueba que tanto su presión como su volumen han disminuido, mientras que su temperatura ha sufrido un aumento. ¿Qué conclusión podemos extraer?





