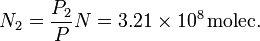Volumen y número de moléculas de un gas GIA
De Laplace
Contenido |
1 Enunciado
Utilizando la ecuación de estado de los gases ideales, responde a las siguientes preguntas
- ¿Qué volumen ocupa un mol de gas en condiciones estándar?
- ¿Cuantas moléculas hay en
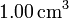 de gas ideal a una temperatura de
de gas ideal a una temperatura de 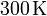 y a un presión de
y a un presión de 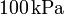 ? ¿Y si la presión es de
? ¿Y si la presión es de 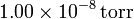 ?.
?.
2 Solución
2.1 Volumen de un mol de gas en condiciones estándar
La definición de condiciones estándar depende del organismo que fije el estándar. Nosotros seguiremos las recomendaciones de la International Union of Pure and Applied Chemistry (IUPAC). Esta organización fija las condiciones estándar para un gas cómo una temperatura de 0oC y una presión de 100 kPa.
Recurrimos a la ecuación de estado de un gas ideal para obtener el volumen ocupado por un mol de gas. Tenemos
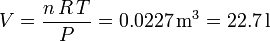
2.2 Número de moléculas
En las condiciones del enunciado el número de moles del gas es
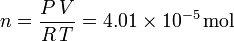
En cada mol hay el número de Avogadro de moléculas. Entonces el número total de moléculas es
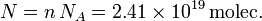
El número de moles, y por tanto el número de moléculas, es proporcional a la presión. Si la presión es ahora P2, el número de moléculas es