Primer principio de la termodinámica (GIE)
De Laplace
Contenido |
1 Calor y trabajo en termodinámica
En los artículos sobre trabajo y calor se dan las definiciones de estas magnitudes en termodinámica:
- Definición de trabajo
- “El trabajo es una transferencia de energía a través de la frontera de un sistema asociada a un cambio en las variables macroscópicas.”
- Definición de calor
- “El calor es la transferencia de energía a través de la frontera de un sistema debida a una diferencia de temperaturas”
Estas dos definiciones tienen bastantes similitudes, pero también algunas importantes diferencias.
- Tanto el trabajo como el calor son transferencias de energía, es decir, son flujos de energía de un sitio a otro, no son algo que se tiene o se almacena.
- Calor y trabajo se localizan en la frontera del sistema, es una entrada o salida por las paredes del sistema, y no se refiere al interior de éste. Si una parte de un sistema realiza trabajo sobre otra parte del mismo, ello no implica ningún trabajo sobre el sistema. Análogamente con el calor.
- Se miden en las mismas unidades, que en el sistema internacional son julios. Por razones históricas, el calor también se expresa a menudo en calorías.
- Los dos son funciones del camino, es decir que se puede ir del estado A al estado B por multitud de procesos diferentes y en cada uno de ellos el trabajo será distinto, y lo mismo ocurre con el calor.
- La principal diferencia es que:
- El trabajo está asociado al cambio de las variables macroscópicas, como pueden ser el volumen, la presión, la posición y velocidad del centro de masas, el voltaje, etc. Por ejemplo, se realiza trabajo cuando se acelera un objeto, cambiando la velocidad de su CM.
- El calor, a diferencia del trabajo, está asociado a la diferencia de temperatura, que es una medida de la agitación de los átomos y moléculas. Por tanto, se debe a la transferencia de energía a través de fenómenos microscópicos.
2 Primer principio de la termodinámica
El primer principio de la termodinámica se compone de tres partes, que examinaremos sucesivamente.
2.1 Equivalente mecánico del calor
En las definiciones anteriores se enuncia explícitamente que calor y trabajo son dos formas diferentes de transferencia de energía. Sin embargo, esto no era evidente en los primeros tiempos de la termodinámica.
El calor era algo que pasaba de los cuerpos calientes a los fríos y que estaba asociado exclusivamente al cambio de temperaturas. También a los cambios de fase, de ahí que a la entalpía de fusión se la denominara “calor latente” de fusión. Una caloría se definió como la cantidad de calor necesaria para elevar la temperatura de 1 g de agua de 14°C a 15°C.
El trabajo, en cambio, era un concepto mecánico, asociado al movimiento de los cuerpos. Nada que ver con las temperaturas. Su unidad de medida (hoy día el julio) es una combinación de masas, distancias y tiempos.
Sin embargo, la experiencia muestra que ambas magnitudes están relacionadas. El conde Rumford fue el primero en sugerir establecer una relación numérica a partir de sus experimentos de que puliendo cañones (esto es, realizando trabajo sobre ellos) se elevaba su temperatura.
Fue Joule el primero en establecer esta relación numérica, calculando el “equivalente mecánico del calor” (que en rigor, debería denominarse el “equivalente térmico del trabajo”). Para ello realizó una serie de experimentos que, en esencia, consisten en lo siguiente.
Midió en primer lugar el calor necesario para elevar la temperatura del agua una cierta cantidad.
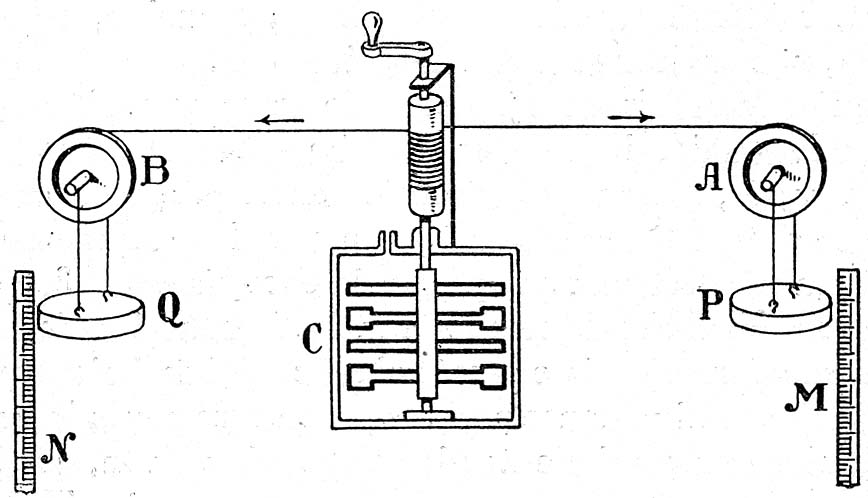
A continuación procedió a aislar térmicamente el recipiente y mediante una rueda de paletas conectada a una pesa procedió a remover el agua. El descenso de la pesa permitía medir el trabajo realizado y con la agitación del agua se elevaba su temperatura. Comparando el aumento de temperatura mediante agitación con el obtenido añadiendo calor, pudo establecer la equivalencia numérica entre ambos procesos. Su resultado fue muy próximo al valor admitido actualmente, que es
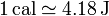
(existen diferentes definiciones de caloría, cada una con su correspondiente equivalencia).
Por tanto, los experimentos de Joule mostraban que calor y trabajo eran dos facetas del mismo fenómeno y por tanto podían sumarse o transformarse el uno en el otro.
2.2 Enunciado del primer principio
Sección 2-6 de Çengel & Boles (6ª ed.)
Los experimentos de Joule no se limitaron a establecer la equivalencia física de calor y trabajo. A base de realizar medidas precisas, pudo establecer el siguiente resultado:
- “En un sistema aislado térmicamente, el trabajo necesario para pasar de un estado A a un estado B es independiente del camino”
es decir, es indiferente si la pesa se deja caer lenta o rápidamente, o si en lugar de una pesa colocamos un motor eléctrico para mover las paletas, o instalamos un resorte que se va extendiendo, a misma cantidad de trabajo, mismo aumento de temperatura.
Esto un cambio importante respecto a lo que ocurre habitualmente con el trabajo, que es una función del camino y por tanto no produce los mismos resultados según como se aplique. La independencia del camino sólo se produce si el proceso es adiabático, Q = 0.
Si el sistema no está aislado térmicamente, ya el efecto del trabajo depende del camino. Midiendo independientemente el calor que entra en el sistema, Joule pudo establecer el Primer Principio de la Termodinámica, que hoy podemos formular de la siguiente manera:
- “En un sistema que evoluciona desde un estado a otro, la suma del calor y el trabajo que entran en el sistema durante el proceso es independiente del camino”
Es decir que en un proceso general, no adiabático, en el que el sistema pasa del estado A a B
- El trabajo depende del proceso.
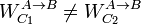
- El calor depende del proceso.
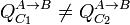
- La suma del calor y el trabajo es independiente del proceso.
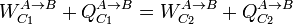
En el enunciado anterior consideramos como positivo tanto el calor como el trabajo que entran en el sistema.
A modo de ilustración consideremos una compresión de un volumen inicial (estado A) de 3 L de aire seco, inicialmente a 100 kPa, que se comprimen hasta ocupar 1 L a 400 kPa (estado C) y que pasamos de un estado al otro por dos caminos cuasiestáticos diferentes:
- Una compresión isóbara seguida de un calentamiento isócoro.
- Un calentamiento isócoro seguido de una compresión isóbara.
Se trata de hallar el calor y el trabajo que entran en el gas por los dos caminos y ver si su suma es la misma.
En el primer camino tenemos en primer lugar una compresión a presión constante pA desde un volumen VA hasta un estado B de la misma presión y volumen VC. El trabajo en este paso vale
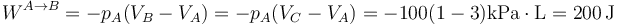
y el calor que entra en el aire
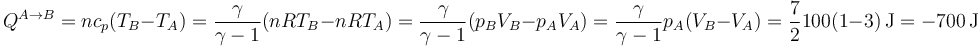
(vemos que, en realidad sale). En el segundo paso el trabajo es nulo por ser a volumen constante
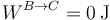
mientras que el calor es el correspondiente a un proceso isócoro
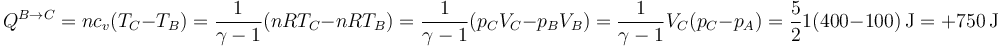
Reuniendo ambos resultados obtenemos
| W (J) | Q (J) | Q+W (J) | |
|---|---|---|---|
| A→B | +200 | −700 | −500 |
| B→C | 0 | +750 | +750 |
| A→B→C | +200 | +50 | +250 |
En el segundo camino tenemos en primer lugar el calentamiento isócoro hasta un estado D de volumen VA y presión pC

y
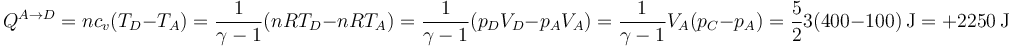
El segundo paso es ahora el enfriamiento a presión constante
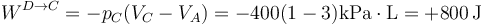
y
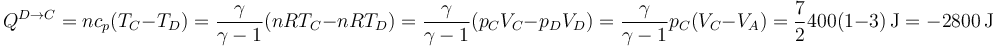
Reuniendo los dos pasos
| W (J) | Q (J) | Q+W (J) | |
|---|---|---|---|
| A→D | 0 | +2250 | +2250 |
| D→C | +800 | −2800 | −2000 |
| A→D→C | +800 | −550 | +250 |
Vemos que aunque los intercambios de calor y trabajo en cada paso y cada camino son diferentes, la suma de calor y trabajo en el proceso completo es exactamente la misma.
2.3 Existencia de una función de estado
Sección 2-2 de Çengel & Boles
La independencia del camino tiene una consecuencia inmediata crucial:
- “La suma del trabajo y el calor en un proceso es igual al incremento de una función de estado.”
A esta función de estado se la denomina energía total. Recordemos que una función de estado es aquella cuyo valor queda completamente definido cuando conocemos los valores de las diferentes variables que definen el estado del sistema (presión, volumen, temperatura,…) y no se precisa saber cómo se ha llegado a ese estado. Cuando se tiene una función de estado, su incremento es simplemente su valor en el estado final menos su valor en el estado inicial
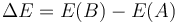
independientemente de que el proceso sea cuasiestático o no lo sea.
De esta forma el primer principio de la termodinámica se escribe
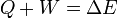
(si se adopta el criterio de que el trabajo positivo es el que sale, sería Q − W = ΔE; es importante, al consultar la bibliografía, revisar cómo se enuncia el primer principio, para saber qué criterio de signos se está empleando).
En forma diferencial, tenemos que para pasar de un estado a uno muy próximo,
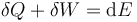
Nótese la diferencia en la notación de los diferenciales.
El valor de la energía total, sin entrar en su significado físico, que veremos después, puede construirse a partir de la expresión anterior, de la misma manera que se hace con la energía potencial en mecánica. Consideramos un estado de referencia O, al que le asignamos una energía E0. La energía de cualquier otro estado viene dada por la suma del calor y el trabajo necesarios para llegar hasta él.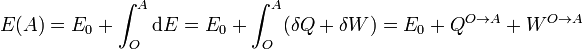
Para ir de un estado A a un estado B podemos elegir un camino arbitrario (porque la suma no depende del camino), por lo que siempre podemos elegir uno que pase por O. De esta forma resulta que la la suma del calor y el trabajo para ir de A a B es la diferencia entre los dos valores de la energía que acabamos de definir.
3 Energía total y energía interna
¿Qué es la energía total? El primer principio de la termodinámica no nos dice qué es, sino solo cuánto vale su incremento. Sin embargo, en mecánica, el trabajo que se realiza sobre un sistema se manifiesta como un aumento de su energía cinética, de su energía potencial o de ambas. En termodinámica, la energía es una generalización del concepto mecánico.
La energía total representa la suma de todas las formas de energía almacenadas por un sistema:
- Cinética
- Potencial
- Eléctrica
- Química
- Nuclear
- De agitación térmica
- …
Este conjunto se puede escribir como la suma
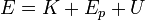
donde K es la energía cinética macroscópica (asociada al movimiento del CM o alrededor de él, como se ve en mecánica, Ep es la energía potencial del sistema debida a fuerzas externas (asociada habitualmente al peso) y U representa a todo el resto de formas de energía. A este resto se lo denomina energía interna.
La energía interna U engloba toda clase de formas de energía salvo las que ya hemos descontado. Incluye parte de energía cinética (lo que denominamos agitación térmica es la energía cinética asociada al movimiento aleatorio de las partículas), parte de energía potencial (la debida a las interacciones entre las partículas del propio sistema), más la química, nuclear, etc. Normalmente no se dispone de una teoría que nos diga, a partir de principios fundamentales, cuánto vale la energía. Simplemente nos limitamos a calcular su incremento mediante el primer principio de la termodinámica.
En muchos casos, la energía mecánica (cinética más potencial) del sistema permanecen constantes en el proceso, en ese caso
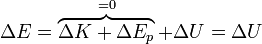
y el primer principio se reduce a
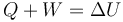
Aunque esta es la forma en que se escribe directamente a menudo, hay que precisar que sólo es correcta en el caso de constancia de las otras dos formas de energía.
La energía interna es una propiedad extensiva del sistema, que se mide en julios. A partir de ella pueden definirse dos magnitudes específicas, la energía interna por unidad de masa, o por mol
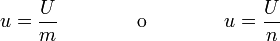
4 Lecturas del primer principio
Aunque se trata de una sola ecuación, podemos leerla de múltiples formas, y considerar diferentes casos, según los signos o la anulación de alguno de los términos. Consideraremos que los términos de energía cinética y potencial son constantes o despreciables.
Para empezar, en muchas ocasiones podemos distinguir si se está haciendo trabajo sobre el sistema o es el sistema el que lo hace sobre el entorno. Lo mismo con el calor. En esos casos, podemos hacer la descomposición

con lo que podemos escribir el primer principio como
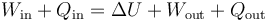
Entre los casos posibles tenemos
- Procesos en que no se realiza trabajo
- En particular en un sistema rígido, para el cual el volumen es constante
- Si W = 0 y Qout = 0, queda
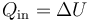
- El calor suministrado a un sistema rígido (a volumen constante, en el caso de un fluido) se almacena como energía interna, lo que se manifiesta como un aumento de la temperatura. La temperatura, por tanto, no es una manifestación del calor, sino de la energía interna.
- Inversamente si W = 0 y Qin = 0, queda

- que leemos como que si de un sistema rígido sale calor su energía interna (y por tanto su temperatura) disminuye.
- Procesos adiabáticos
- Si el sistema está aislado térmicamente del exterior, Q = 0
- Si Q = 0 y también es nulo Wout (el sistema no realiza trabajo) el primer principio se reduce a
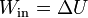
- que nos dice que el trabajo que entra se emplea en aumentar la energía interna del sistema, es decir, que aumenta su temperatura. Este sería el equivalente mecánico del calor que estableció Joule.
- Si Q = 0 y también es nulo Win (no se realiza trabajo sobre el sistema) nos queda
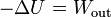
- que se lee como que si un sistema realiza trabajo adiabáticamente lo hace a costa de su energía interna.
- Procesos a energía interna constante
- Si la energía interna del sistema no cambia en un proceso (por ejemplo, en un gas ideal en el que se mantiene constante la temperatura) tenemos
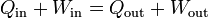
- que leemos como que si la energía permanece constante, todo lo que entra en una parte del proceso debe salir por otra. En particular, si algunos de los términos se anulan puede darse una de estas situaciones
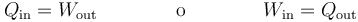
- que nos dice que es posible un proceso en el que el sistema absorba calor pero no aumente su temperatura, sino que este calor se emplee en realizar trabajo. Una expansión isoterma de un gas sería un ejemplo de esto. Igualmente, puede ocurrir que el trabajo suministrado a un sistema escape de este en forma de calor. Esto es lo que ocurre en una estufa eléctrica.
Por supuesto, podemos tener todos los casos posibles, incluyendo el que todos los términos sean no nulos y que en un sistema entre y salga calor y trabajo, mientras cambia su energía interna.
5 Procesos cíclicos
Un tipo particular de proceso que es especialmente importante es el de los procesos cíclicos. Las máquinas y motores, térmicos o de otro tipo, operan siguiendo este tipo de procesos.
Se caracterizan porque el estado final es el mismo que el inicial. Por ello, la energía total en el estado final tiene el mismo valor que en el estado inicial y
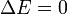
lo cual implica que
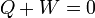
Si desglosamos el calor y el trabajo en lo que entra y lo que sale, queda
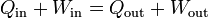
Si se considera el proceso paso a paso, queda la relación integral
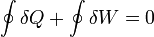
donde el círculo en la integral significa proceso cíclico.
En el caso de que el proceso cíclico sea cuasiestático, y por tanto pueda representarse en un diagrama de estado, podemos hallar el trabajo neto como el área delimitada por la curva que describe el proceso. La relación anterior nos dice que el calor neto, en valor absoluto, es también igual a la misma área.
Como casos particulares de sistemas que funcionan mediante procesos cíclicos tenemos los de las máquinas térmicas, los refrigeradores y las bombas de calor.
6 Flujos de calor y trabajo
Si en lugar de conocer el trabajo total realizado sobre el sistema o el calor que entra en él, lo que conocemos es la potencia desarrollada (trabajo por unidad de tiempo) y el flujo de calor por segundo, el primer principio se escribe
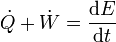
y en situaciones en que la energía mecánica es constante
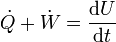
o, desglosando
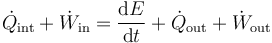
7 Entalpía
Supongamos una reacción química que ocurre en un recipiente abierto. Por ejemplo, una cierta cantidad de hidrógeno gaseoso que se combina con el oxígeno del aire para dar agua. Esta reacción libera calor ya que la energía química del producto (el agua) es inferior a la de los reactivos (hidrógeno y oxígeno). Sin embargo, el calor liberado no coincide con la disminución en la energía interna. La razón es que en esta reacción se realiza trabajo y
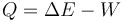
El trabajo en este proceso viene de que el volumen que ocupa el producto es mucho menor que el que ocupaban los reactivos y por tanto se ha producido una compresión. Este trabajo lo realiza la presión atmosférica; si no hubiera presión externa el agua no se quedaría líquida, sino que se vaporizaría.
A la inversa, consideremos la reacción de combustión de un hidrocarburo como la gasolina, que produce dióxido de carbono y agua. Puesto que el CO2 ocupa mucho más volumen que la gasolina, el calor liberado es menor que la disminución en la energía, ya que parte de ésta se va en hacer trabajo, al desalojar el dióxido de carbono parte de la atmósfera circundante.
Por ello, no nos basta tabular la energía interna de las diferentes sustancias para saber el calor que se libera en una reacción concreta, sino que es necesario hacer un cálculo adicional del trabajo que conlleva.
Nos preguntamos entonces si existe alguna otra magnitud cuyo valor sí nos de directamente el calor absorbido o liberado en un proceso a presión constante.
La respuesta es que sí existe. En un proceso a presión constante el trabajo vale
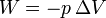
y por tanto el calor absorbido es igual a
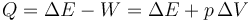
Escribimos los incrementos como diferencia entre dos estados
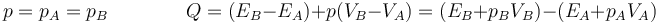
Si definimos una nueva función de estado, denominada entalpía de un fluido, como

el calor en un proceso a presión constante se puede expresar
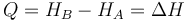
Es decir el calor que entra en un proceso cuasiestático a presión constante es igual al incremento de la entalpía del sistema. Para el estudio de las reacciones químicas, entonces, lo que hay que tabular -y lo que se tabula, de hecho- es la entalpía de reactivos y productos y el calor se calcula a partir de su diferencia.
La entalpía es una magnitud extensiva, que se mide en julios en el SI. A partir de ella pueden definirse dos magnitudes específicas, por unidad de masa o por mol
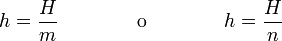
Dado que los cambios de fase como los del agua, se suelen estudiar en sistemas abiertos a la atmósfera, y por tanto a presión constante, lo que se mide es el calor absorbido por la sustancia a p constante. Por ello, el dato experimental es la entalpía de fusión (o de vaporización), y no la energía interna de fusión.
Dada la entalpía, la energía total puede hallarse restando el término pV
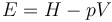
En el caso de que sean despreciables los cambios en la energía cinética y la potencial se obtienen relaciones análogas pero con la energía interna

Esta relación permite calcular el calor en diferentes procesos como diferencias de funciones de estado que están tabuladas.
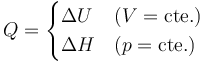
8 Energía de un gas ideal
Sección 4-4 de Çengel & Boles
En principio, la energía interna de un sistema depende de todas las variables de estado (presión, temperatura,…). La relación concreta dependerá de cada sistema, a través de la denominada ecuación térmica de estado
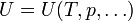
En el caso particular de los gases ideales, Joule hizo el siguiente experimento: Conectó dos recipientes iguales, aislados térmicamente del exterior. En uno de ellos situó un gas a presión p0 y temperatura T0. En el otro tanque hizo el vacío. En un momento dado rompió el diafragma de comunicación entre los dos tanques, de forma que el gas se expandió hasta ocupar los dos recipientes. Como resultado de la expansión, el volumen ocupado aumentó, mientras que la presión del gas se redujo. Sin embargo, la temperatura, medida antes y después de la expansión no cambió sustancialmente. ¿Qué implica esto para la energía interna?
Al estar aislados térmicamente los dos recipientes, el proceso es adiabático
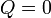
Por otro lado, el trabajo sobre el gas es nulo, puesto que se expande contra el vacío

Por el primer principio de la termodinámica
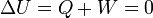
Tenemos entonces que
- La presión del gas cambia
- El volumen del gas cambia
- La temperatura del gas no cambia
y que
- La energía interna del gas no cambia
Por tanto, se llega a la conclusión de que
- La energía interna de un gas ideal depende exclusivamente de su temperatura.
Para obtener la expresión para la energía, suponemos un proceso en el que el gas se calienta a volumen constante. En este caso el trabajo es nulo y
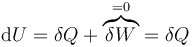
El gas añadido a volumen constante implica un aumento de la temperatura, lo que nos da
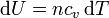
e integrando esta relación
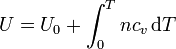
Puesto que en general la capacidad calorífica es una función de la temperatura, para hallar el valor de esta integral habrá que recurrir a medidas y tablas.
Si se hace la aproximación de que cv es independiente de la temperatura (lo cual es aproximadamente cierto en muchos casos), esta integral se reduce a
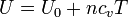
En este caso la energía interna de un gas ideal varía linealmente con la temperatura. El valor de la energía U0 no lo podemos determinar (ya que en el cero absoluto el gas ni siquiera sería gas), pero estamos interesados casi exclusivamente en los incrementos, para los cuales
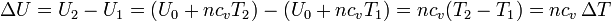
Puesto que la energía interna es una función de estado, la expresión anterior nos da el cambio de la energía interna en cualquier proceso. Es decir, que si ahora consideramos un calentamiento a presión constante, no hay que cambiar cv por cp.
8.1 Procesos en un gas ideal
Consideramos ahora el trabajo, calor y aumento de la temperatura en una serie de procesos elementales cuasiestáticos. Suponemos que las capacidades caloríficas son independientes de la temperatura.
8.1.1 Calentamiento isócoro
Como se ha mencionado, en un proceso a volumen constante, no se realiza trabajo sobre el gas
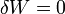
y por tanto la variación de energía interna es igual al calor que entra en el sistema

y en el proceso completo
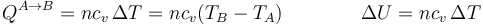
Aplicando la relación entre la capacidad calorífica y la constante de los gases ideales
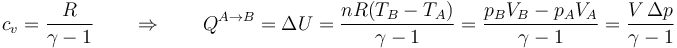
donde hemos podido sacar el volumen como factor común por ser éste constante.
8.1.2 Calentamiento isóbaro
Si lo que se mantiene constante es la presión, ya el trabajo no es nulo, puesto que el volumen cambia. Al calentarse el gas, su presión supera ligeramente a la exterior y el gas se expande hasta alcanzar de nuevo el equilibrio mecánico. El trabajo diferencial sobre el gas es
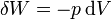
y el total
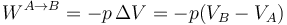
Aplicando aquí la ley de los gases ideales queda
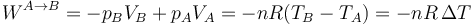
En un proceso cuasiestático a presión constante, el calor que entra es proporcional al incremento de temperatura
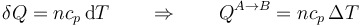
También la variación de la energía interna es proporcional a la diferencia de temperaturas, pero con una constante diferente, ya que en la energía interna de un gas ideal siempre aparece cv, no cp
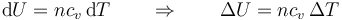
De acuerdo con el primer principio de la termodinámica
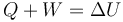
Sustituimos aquí las expresiones anteriores
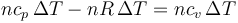
y obtenemos la ley de Mayer

El calor y la variación de la energía interna pueden ponerse en función de las presiones y volúmenes

La diferencia entre las dos cantidades la da el trabajo realizado, ya que
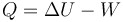
que nos dice que el calor que entra en el sistema parte se emplea en aumentar la temperatura y parte se emplea en forma de trabajo expandiendo el gas.
8.1.3 Compresión isoterma
8.1.3.1 Caso no cuasiestático
Un sistema que no esté aislado térmicamente y se halle sumergido en un baño térmico tendrá, al final de cada proceso la misma temperatura que al principio. Sin embargo, esto no convierte a estos procesos en isotermos, ya que, en medio, puede haber cambiado la temperatura del sistema (suponiendo que ésta pueda definirse, lo cual no siempre es posible, si el proceso no es un cambio gradual y homogéneo).
No obstante, con esta salvedad, es posible establecer resultados generales. Si la temperatura final es la misma que la inicial, la energía interna del gas ideal (que depende solo de T) no cambia
Puesto que la energía interna de un gas ideal depende solo de su temperatura, si esta no cambia
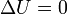
y por tanto
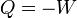
Esto quiere decir que si un gas se expande de manera isoterma, y realiza trabajo sobre el entorno, debe estar entrando calor en la misma cantidad. A la inversa si se comprime. Es decir, este es un proceso en el que la entrada de calor en un sistema ni produce un aumento de temperatura ni un cambio de fase.
En una compresión abrupta por un peso, descrita en un problema, se trata realmente un proceso a presión constante. Si el gas está inicialmente en un estado A y se aumenta la presión a un valor pB, que luego se deja constante, el trabajo que se realiza es
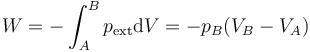
donde el volumen final sale de la ley de Boyle
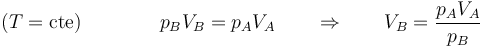
lo que da para el trabajo
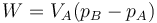
y para el calor

En este proceso, si el gas se expande, entra calor y sale trabajo, y a la inversa si se comprime.
8.1.3.2 Caso cuasiestático
En el caso de una expansión isoterma cuasiestática el trabajo es igual a
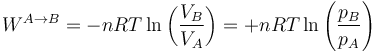
Aplicando aquí la ley de los gases ideales, si lo que conocemos son la presión y el volumen iniciales (o los finales)
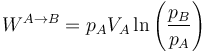
y por tanto el calor que entra en el sistema es
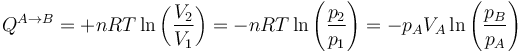
Si el gas se expande de manera isoterma el calor entra en el sistema y si se contrae sale de él.
8.2 Proceso adiabático
Por último, en un proceso adiabático tenemos que en cada paso
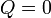
y por tanto
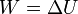
La variación de la energía la conocemos en función de los estados inicial y final
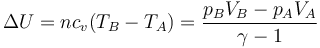
pero el trabajo depende del proceso, por lo que no existe un único estado final en un proceso adiabático (aunque como se ve al estudiar el Segundo Principio de la Termodinámica, no todos los estados finales son posibles)
8.2.1 Caso no cuasiestático
Un caso simple de proceso adiabático no cuasiestático sería el de la compresión por un incremento súbito de la presión, tal como se ve en un problema. Si tenemos un gas en un estado A y bruscamente la presión externa se aumenta a un valor pB, que a partir de ese momento se mantiene constante, el trabajo que se realiza sobre el sistema es
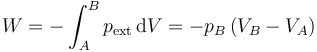
Este trabajo se almacena en forma de energía interna, lo que vemos como un aumento de la temperatura del gas
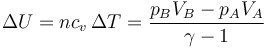
Igualando el trabajo al aumento de la energía interna hallamos el volumen final del gas
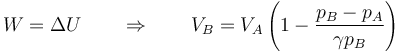
que también podemos escribir como una relación entre incrementos relativos

Sustituyendo el volumen final en la expresión del trabajo nos queda
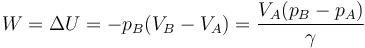
Dado que γ > 1 esto quiere decir que, a igualdad de aumento de presiones, este trabajo es menor que en un proceso isotermo en el que se aumenta la presión bruscamente (ahí se obtiene el mismo resultado, pero sin γ).
8.2.2 Caso cuasiestático
Supongamos ahora un proceso adiabático en el que la presión se aumenta gradualmente. ¿Cómo varían el volumen y la temperatura al aumentar la presión?
Tenemos que en cada paso se cumple
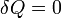
lo cual reduce el primer principio a

Podemos aprovechar el resultado del apartado anterior, suponiendo que la presión pB es solo ligeramente superior a la inicial en cada paso. En ese caso, la relación
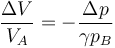
se convierte en una relación entre diferenciales
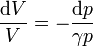
Cuando tenemos un aumento finito (pero gradual) de la presión, sumamos los diferenciales (es decir, integramos)

Podemos eliminar los logaritmos agrupando términos
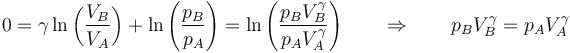
Puesto que B es cualquier estado del proceso tenemos, en un proceso adiabático cuasiestático de un gas ideal se cumple la relación, para todos los puntos,
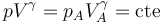
Esta relación se conoce como ley de Poisson y nos dice que un proceso adiabático cuasiestático de un gas ideal es un proceso politrópico de exponente k = γ = cp / cv (1.4 para el caso del aire).
Gráficamente, la curva en un diagrama pV es de aspecto hiperbólico, pero de mayor pendiente que una isoterma.
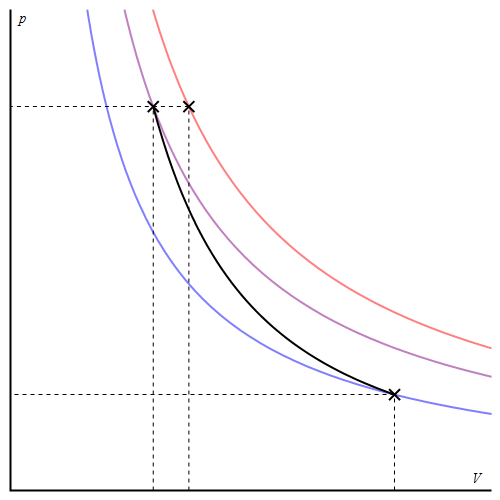
Como comparación, para el caso de la compresión brusca resulta un volumen final mayor y por tanto una mayor temperatura. Esto es una consecuencia general del segundo principio de la termodinámica.
Sustituyendo en la ley de Poisson la ley de los gases ideales obtenemos relaciones para la temperatura y el volumen
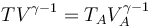
y para la temperatura y la presión
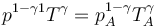
8.3 Entalpía de un gas ideal
En el caso de un gas ideal, el calor absorbido por el gas en un proceso cuasiestático a presión constante es
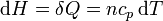
y por tanto la entalpía de un gas ideal vale
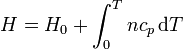
Si se hace la aproximación de que la capacidad calorífica no depende de la temperatura, esto se reduce a
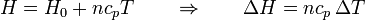
Puesto que la entalpía es una función de estado, esta expresión para su incremento vale también aunque el proceso no sea a presión constante. En todo proceso, se cumple

(suponiendo capacidades independientes de la temperatura).











