Trabajo en termodinámica (GIE)
De Laplace
Contenido |
1 Trabajo
(Sección 2-4 de Çengel & Boles (6ª Ed.) )
1.1 Definición
Una posible definición de trabajo en termodinámica sería la siguiente:
- “El trabajo es una transferencia de energía a través de la frontera de un sistema asociada a un cambio en las variables macroscópicas.”
En esta definición hay que remarcar varios aspectos que se explican en las secciones siguientes y en los artículos relativos al calor y al primer principio de la termodinámica:
- El trabajo es una transferencia de energía, es decir, es un paso de energía de un sitio a otro, no es algo que se tiene o se almacena.
- El trabajo se localiza en la frontera del sistema, es una entrada o salida por las paredes del sistema, y no se refiere al interior de éste.
- Está asociado al cambio de las variables macroscópicas, como pueden ser el volumen, la presión, la posición y velocidad del centro de masas, el voltaje, etc. (pero no la temperatura, que es microscópica) Se realiza trabajo cuando se acelera un objeto, cambiando la velocidad de su CM. Por contra, si lo que se hace es aumentar la temperatura de un gas, incrementando la energía cinética de cada partícula, a este proceso lo llamamos calor.
1.2 Trabajo diferencial
El concepto de trabajo en termodinámica es una generalización de la correspondiente definición de trabajo en mecánica. Cuando tenemos una fuerza F actuando sobre una partícula, de forma que ésta se desplaza una cantidad dx en la dirección y sentido de la fuerza, el trabajo realizado es igual a
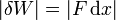
Si tenemos tres componentes de la fuerza y un desplazamiento arbitrario, el trabajo diferencial es la suma del realizado por cada una de las componentes
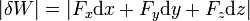
En esta expresión se usa “δ” (delta) para el trabajo diferencial en lugar de “d” para indicar que el trabajo no es la variación de ninguna cantidad, no es “el trabajo ha aumentado en δW”, sino “se ha realizado un trabajo δW”. Para un mismo desplazamiento puede haber muchos valores del trabajo posibles, dependiendo de la fuerza que se haya aplicado.
Este concepto se extiende de forma inmediata al trabajo sobre un fluido (líquido o gas). Supongamos que tenemos un gas limitado por una frontera móvil, como un émbolo, sobre la cual se aplica una presión pext. La fuerza ejercida sobre el émbolo será
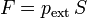
mientras que la variación en el volumen del fluido es proporcional al desplazamiento del pistón
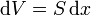
Esto nos da el valor absoluto del trabajo diferencial

De aquí obtenemos una relación entre unidades. Si empleamos el SI para cada una de las magnitudes se cumple
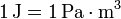
De esta relación se ve la ventaja de usar pascales como unidad de presión, ya que si multiplicamos la presión por el cambio de volumen, medido también en el SI, el resultado ya está directamente en julios. En cambio, si se mide la presión en atmósferas o milímetros de mercurio, el volumen en litros o el trabajo en calorías, es preciso introducir factores de conversión para completar los cálculos.
1.3 Convenio de signos
En las expresiones anteriores se ha empleado el valor absoluto porque queda por definir el criterio de signos para el trabajo. Por desgracia, no existe unanimidad de criterios y es importante, al consultar una referencia, el tener claro qué criterio se usa.
Aquí seguiremos el criterio de la IUPAC según el cual
- Si el trabajo se realiza por el entorno sobre el sistema, es positivo
- Si el trabajo es realizado por el sistema sobre el entorno, es negativo
Físicamente veremos, al enunciar el primer principio de la termodinámica, que este criterio se puede enunciar como que aquél trabajo que aumenta la energía interna es positivo y el que la reduce es negativo (la elección opuesta es bastante frecuente en los libros de texto, ya que se origina en el estudio de las máquinas térmicas, en las que interesa que el sistema –la máquina– realice trabajo y por tanto se considera positivo al realizado por el sistema).
Con este criterio, podemos asignarle el signo correcto a las expresiones anteriores. Consideremos un volumen de gas que se comprime por causa de una presión externa. En este caso se hace trabajo sobre el sistema, por lo que debe resultar un valor positivo. Por otro lado, en este proceso el diferencial de volumen es negativo (ya que se reduce), por lo que debe ser
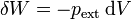
Esta misma fórmula vale para el caso de la expansión, para el cual dV > 0 y δW < 0.
Una forma de evitar los problemas que da la elección de un criterio consiste en evitar elegirlo, simplemente hablando de dos tipos de trabajo
- Win, el trabajo realizado sobre el sistema.
- Wout, el trabajo realizado por el sistema.
Si al analizar un proceso sabemos de antemano cuándo se realiza trabajo o cuándo se recibe, puede denominarse Win y Wout, suponiendo que ambos son positivos (aunque no hay problema alguno en que sean negativos, simplemente significa que va en sentido opuesto al que habíamos supuesto). Con esta notación el trabajo neto que entra en el sistema es
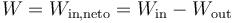
De la misma manera, el trabajo neto que sale será el opuesto

1.4 Trabajo en un proceso
Cuando tenemos un proceso en un sistema que lo lleva del estado A al estado B, el trabajo neto realizado será la suma de los trabajos diferenciales
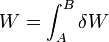
En el caso particular de un trabajo de compresión sobre un fluido
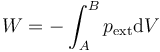
Esta expresión no puede representarse en un diagrama pV, ni es el área bajo ninguna curva en dicho diagrama. Recordemos que en un diagrama pV solo se representan estados de equilibrio y las coordenadas son los valores de las variables de estado (presión y volumen, por ejemplo) del sistema. En la expresión del trabajo aparece la presión externa, que puede o no coincidir con la interna (si es que ésta existe).
El concepto de trabajo es aplicable tanto a procesos cuasiestáticos como a cualquier otro, por lo que no hay que suponer que el sistema se encuentra en equilibrio cuando se realiza trabajo sobre él. De hecho, lo más habitual es que no este en equilibrio. Consideremos el proceso descrito en el problema “Trabajo en una compresión isoterma por un peso”. En este sistema, sobre un cilindro con pistón se aplica bruscamente un peso extra, de forma que la presión externa aplicada aumenta de pA = patm a pB = patm + mg / S. El resultado es que el pistón baja y el gas se comprime. Se alcanza de nuevo el equilibrio cuando la presión interior iguala a la nueva presión exterior y la temperatura iguala a la del ambiente.
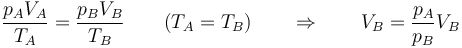
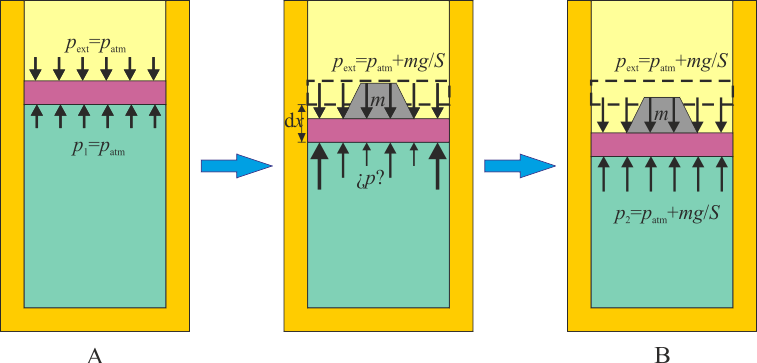
Este proceso es claramente no de equilibrio. Un golpe brusco provoca turbulencias en el gas, hace que la presión varíe de un punto a otro (lo que se manifiesta como sonido) y es necesario esperar un tiempo hasta que se vuelva a alcanzar el equilibrio. Podemos, no obstante, hallar el trabajo realizado sobre el gas, al ser la presión externa constante
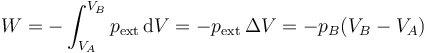
El resultado final se puede relacionar con las variables de estado del sistema, sabiendo que la presión interna final iguala a la externa.
Un caso particular de importancia teórica es el de la expansión libre. Supongamos un tanque de un gas contenido en una cámara alrededor de la cual hay vacío (o separado por una válvula de una cámara vacía). Si se abre la válvula y se deja que el gas se expanda, ¿qué trabajo se realiza? La respuesta es “ninguno”, ya que la presión exterior es nula
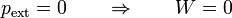
aunque el gas se expande y tiene una cierta presión variable, no debe vencer ninguna resistencia en su expansión y por tanto no realiza trabajo alguno (ni tampoco es realizado sobre el gas).
1.5 Otras formas de trabajo
(Secciones 2-4 y 2-5 de Çengel & Boles)
El trabajo mecánico, sea realizado por una fuerza F o mediante una presión aplicada, es solo uno de los tipos de trabajo posibles. En termodinámica, toda transferencia de energía que no se debe a una diferencia de temperaturas, es una forma de trabajo. Usualmente se asocia a algún tipo de movimiento macroscópico en el sistema. Entre otras posibles formas de trabajo tenemos:
- Trabajo debido al peso
- Si un cuerpo se mueve por acción de la gravedad, sobre él actúa una fuerza de valor mg, por lo que se realiza el trabajo
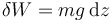
- Trabajo eléctrico
- Cuando tenemos un dispositivo, como una resistencia eléctrica, entre cuyos extremos existe una diferencia de potencial
 y por el cual pasa una carga dQ, se realiza un trabajo sobre el sistema
y por el cual pasa una carga dQ, se realiza un trabajo sobre el sistema
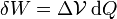
- La cantidad de carga que pasa por un elemento de circuito en un tiempo dt se puede obtener a partir de la intensidad de corriente

- En el caso particular de una resistencia eléctrica, se verifica la ley de Ohm,
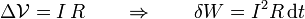
- Trabajo de rotación
- La mayoría de los motores funcionan mediante un eje rotatorio. En este caso, el trabajo realizado es proporcional al ángulo girado
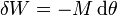
- siendo M la componente del momento de las fuerzas en la dirección del eje de giro. Si conocemos la velocidad angular con la que gira al eje podemos sustituir el ángulo girado
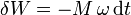
- Trabajo sobre una superficie
- Cuando una superficie (como una lámina de goma o una pompa de jabón) se estira o contrae, se realiza trabajo sobre ella, de manera análoga al caso de la compresión de un volumen. La expresión correspondiente para el trabajo es
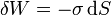
- siendo σ una propiedad del sistema conocida como tensión superficial, análoga a la presión.
2 Trabajo específico
El trabajo es una propiedad extensiva, ya que es proporcional al incremento de volumen y por tanto proporcional a la cantidad de materia que contiene (sobre un sistema el doble de grande se realizará el doble de trabajo). Puede definirse entonces el trabajo por unidad de masa
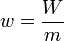
que representaría cuánto trabajo se realiza por cada kilogramo de materia. En el caso de la compresión de un gas tendríamos
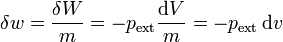
siendo v = V / m el volumen específico, inverso de la densidad de masa.
3 Flujo de trabajo
Cuando la termodinámica se aplica al estudio de las máquinas térmicas y otros dispositivos, más que el trabajo neto acumulado interesa conocer cuánto trabajo se realiza por hora o por segundo. Para ello se define el flujo de trabajo
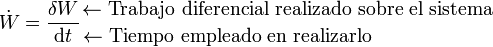
(¡ojo al punto encima de la W!). Este concepto es una generalización de la potencia definida en mecánica (y de hecho, el flujo de trabajo puede denominarse potencia, sin muchas complicaciones). El flujo de trabajo representa la cantidad de energía que entra en el sistema en forma de trabajo en la unidad de tiempo. Se mide en el SI, como la potencia, en vatios (W, no confundir con el trabajo W, ni con el flujo de trabajo 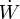 , que van en cursiva). En el caso particular de una central eléctrica, el trabajo que realiza por unidad de tiempo se suele medir en megavatios eléctricos (que son como los demás megavatios, pero sirven para recordar que se habla de la energía eléctrica que produce), que se simbolizan MWe o MWe
, que van en cursiva). En el caso particular de una central eléctrica, el trabajo que realiza por unidad de tiempo se suele medir en megavatios eléctricos (que son como los demás megavatios, pero sirven para recordar que se habla de la energía eléctrica que produce), que se simbolizan MWe o MWe
De acuerdo con las expresiones anteriores, tenemos que el flujo de trabajo es igual a:
- Fuerza aplicada
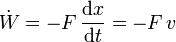
- Compresión
- depende de la velocidad con que varía el volumen:
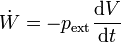
- De una corriente eléctrica

- en particular, para una resistencia eléctrica
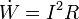
- De un eje rotatorio
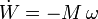
- Sobre una superficie
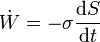
El criterio de signos para el flujo de trabajo es el mismo que para el trabajo. Si está realizándose trabajo sobre el sistema el flujo es positivo; si es el sistema el que lo realiza, es negativo.
Asimismo, puede definirse un flujo de trabajo hacia dentro o hacia fuera del sistema
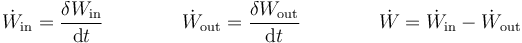
4 Trabajo en un proceso cuasiestático
Cuando tenemos un sistema, típicamente un gas, sobre el cual realizamos un proceso cuasiestático, a base de realizar un trabajo diferencial, dejar que vuelva al equilibrio, realizar otro trabajo diferencial, dejar de nuevo que vuelva al equilibrio, etc. tenemos que el sistema se encuentra siempre aproximadamente en un estado de equilibrio con el exterior. Esto quiere decir que la presión del sistema está definida y será (aproximadamente) igual a la presión externa aplicada
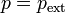
En este caso el trabajo puede calcularse a partir de la evolución del estado del sistema

Un proceso cuasiestático sí puede representarse en un diagrama pV, ya que el sistema está siempre en equilibrio. En este caso, el trabajo posee una sencilla representación gráfica: es el área bajo la curva p(V) entre los dos estados A y B, cambiada de signo.
Cuando conocemos la evolución de la presión como función del volumen podemos hallar el valor del trabajo mediante una integral que puede ser más o menos complicada.
4.1 Caso de un gas ideal
Para el caso de un gas ideal tenemos los siguientes casos simples:
4.1.1 Proceso isócoro
En un proceso a volumen constante, dV = 0 y por tanto no se realiza trabajo sobre el sistema
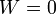
Gráficamente en un diagrama pV, al tratarse de una recta vertical, el área bajo la curva es nula.
Es equivalente a la situación en mecánica en la que tenemos una fuerza aplicada pero no hay desplazamiento. El trabajo es nulo.
En el modelo del cilindro con el pistón correspondería a que el gas se calienta (o enfría) manteniendo atornillada la tapa, como en una olla a presión.
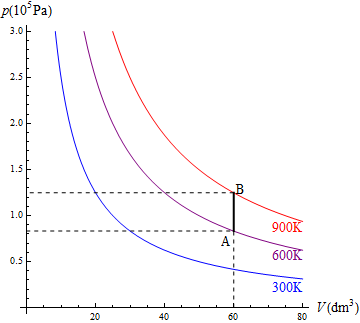
En la figura se ve el caso de un mol de gas que ocupa un volumen de 60 dm³ y cuya temperatura se eleva de 600K a 900K en un recipiente rígido.
4.1.2 Proceso isóbaro
Un proceso a presión constante se representa gráficamente por una línea horizontal. El trabajo es el área bajo este segmento horizontal, cambiada de signo.
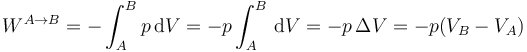
Si el volumen final es mayor que el inicial (expansión) el trabajo es negativo y si es menor (compresión) es positivo.
Teniendo en cuenta que la presión inicial y la final son iguales, este resultado se puede poner en función de la temperatura como
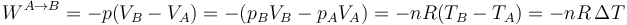
entonces si en un proceso isóbaro aumenta la temperatura de un gas, éste realiza un trabajo de expansión
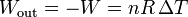
mientras que si se enfría ΔT < 0 y es el entorno el que lo realiza sobre el gas
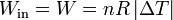
En el modelo del cilindro y el pistón, un proceso isóbaro se consigue permitiendo que el émbolo ascienda o descienda sin rozamiento. Así, al calentarse, el gas se expande libremente, siendo la presión del gas igual en todo momento a la exterior, que es constante.
También es esto lo que ocurre en sistemas abiertos, aunque no se “vea” el trabajo. Si calentamos una cierta cantidad de agua hasta evaporarla, ese vapor debe desalojar una cierta cantidad de aire seco (si no, aumentaría la presión). Ese desalojo, que ocurre a nivel microscópico, donde una moléculas "expulsan" a otras por colisiones, implica la realización de un trabajo, dado por la expresión anterior.
En la figura tenemos el caso de 1.0 mol de gas monoatomico cuya temperatura se baja de 600K a 300K, permitiendo que su volumen, inicialmente de 60 dm³ se reduzca. El trabajo para este ejemplo concreto lo podemos hallar calculando la presión y el volumen finales
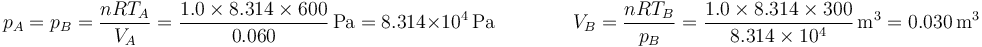
y luego hallando el área del rectángulo
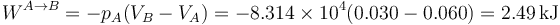
o directamente como
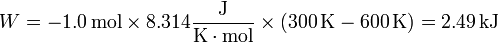
4.1.3 Proceso isotermo
En un proceso cuasiestático a temperatura constante, varían tanto la presión como el volumen. Si el gas se expande su presión se reduce y si se comprime aumenta, cumpliéndose la ley de Boyle

Gráficamente esto corresponde a que el proceso se representa por un arco de hipérbola. El trabajo en este proceso será el área bajo la hipérbola, que se obtiene integrando
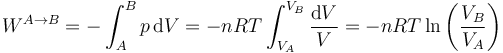
Si lo que conocemos es la presión y el volumen iniciales (o los finales) del gas, este trabajo puede escribirse
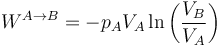
Si el volumen final es mayor que el inicial, el cociente es mayor que la unidad y el logaritmo es positivo, resultando un trabajo negativo. A la inversa si el volumen final es menor que el inicial.
Empleando de nuevo la ley de Boyle podemos escribir el resultado en términos de la relación entre presiones
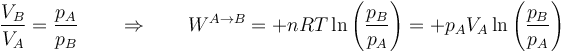
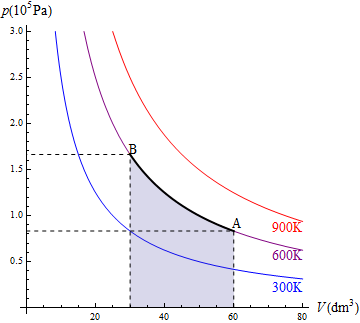
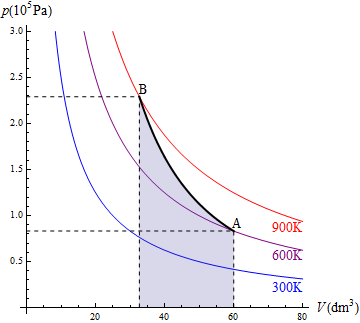
En la figura aparece el caso de 1.0 moles de gas que se encuentran a 600K y ocupan inicialmente 60 dm³. Se comprimen, manteniendo constante la temperatura, hasta que su volumen se reduce a 30 dm³. El trabajo en este proceso vale
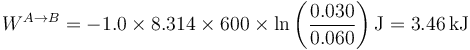
4.1.4 Proceso politrópico
Un proceso politrópico es un tipo general de procesos caracterizado por la relación
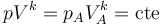
siendo k un cierto exponente real. Entre los casos particulares de procesos politrópicos tenemos
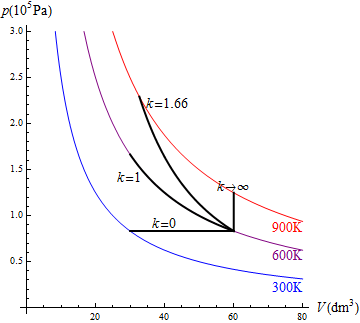
- k = 0 es uno a presión constante.
- k = 1 es un proceso isotermo
- k = γ donde γ = cp / cv, como se ve al estudiar la relación entre calor y trabajo, esta es la ley que gobierna los procesos adiabáticos cuasiestáticos. Como caso particular importante, para el aire γ = 1.4
-
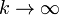 es un proceso a volumen constante.
es un proceso a volumen constante.
El trabajo en un proceso politrópico viene dado por la integral correspondiente
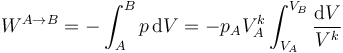
Salvo en el caso k = 1, que corresponde al proceso isotermo del apartado anterior, el resultado de esta integral se deduce de la ley general
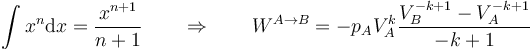
Desarrollando y aplicando de nuevo la relación que define el proceso queda
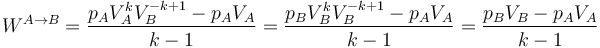
En términos de las temperaturas inicial y final queda, aplicando la ley de los gases ideales
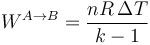
Podemos ver que si 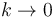 el resultado se reduce al que ya conocemos
el resultado se reduce al que ya conocemos
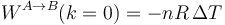
mientras que si 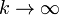 este trabajo se anula, como corresponde a un proceso isócoro
este trabajo se anula, como corresponde a un proceso isócoro
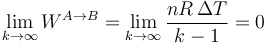
Puede resultar llamativo el aparente cambio de signo dependiendo de cuanto vale k. Si k < 1 el denominador es negativo y si k > 1 es positivo. Parecería entonces que en una compresión podríamos tener trabajos negativos o positivos dependiendo del valor de k. No es así. En un proceso politrópico con k < 1 (por ejemplo, una compresión isóbara) la temperatura desciende al reducir el volumen,
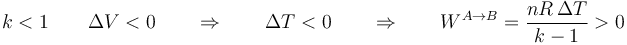
mientras que si k > 1 (por ejemplo, un proceso adiabático, con k = 1.4) la temperatura aumenta al reducir el volumen. En ambos casos resulta un trabajo positivo sobre el gas
En la figura tenemos el caso de una compresión de 1.0 mol de un gas para el cual k = 1.66, que inicialmente ocupa 60 dm³ y pasa su temperatura de 600K a 900K. El trabajo en este proceso lo podemos calcular hallando primero las presiones y volúmenes o bien directamente a partir de la temperatura
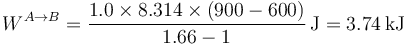
5 Dependencia del camino
Un aspecto del trabajo que ya se ha mencionado, pero sobre el que hay que insistir es que el trabajo no es una función de estado, sino una función del camino. La pregunta “¿qué trabajo hay que hacer para llevar el sistema del estado A al estado B?” carece de respuesta (o tiene infinitas respuestas, según se mire) ya que el trabajo para ir de A a B puede realizarse por muchos procesos y en cada uno el trabajo será distinto.
Incluso si nos restringimos a procesos cuasiestáticos, existe una infinidad de curvas que unen los puntos A y B de un diagrama. El trabajo para cada una es el área bajo la curva, cambiada de signo. Este área dependerá de cómo de cerca del eje pase la curva. Si además consideramos los procesos reales no cuasiestáticos la infinidad se multiplica ya que debemos incluir otros procesos que ni siquiera pueden representarse en un diagrama.
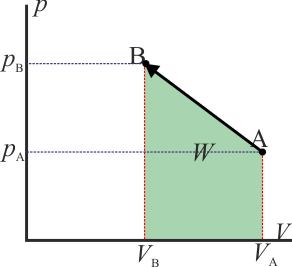
Como ejemplo sencillo consideremos un gas que ocupa inicialmente un volumen VA a una presión pA y temperatura TA. Este gas se comprime cuasiestáticamente hasta que su volumen vale VB = VA / 2 a una presión pB = 2pA. ¿Qué trabajo se realiza?
Estas son algunas de las infinitas respuestas posibles:
- Proceso isóbaro seguido de proceso isócoro
- Podemos comprimir el gas a presión constante, bajando su temperatura, hasta que su volumen es la mitad del inicial. A partir de ahí lo volvemos a calentar a volumen constante hasta que la presión se eleva al doble. Gráficamente corresponde a una recta horizontal seguida de un segmento vertical, siendo C el vértice intermedio. El trabajo en este proceso se realiza sólo en su primera parte
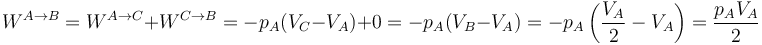
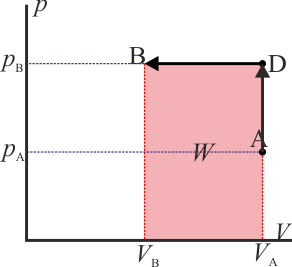
- Proceso isócoro seguido de proceso isóbaro
- Alternativamente, podemos empezar calentando el gas hasta que su presión sea el doble de la inicial (estado D) y luego enfriarlo hasta que se volumen se reduzca a la mitad. Gráficamente es un segmento vertical seguido de uno horizontal. El trabajo se realiza solo en la segunda parte del proceso

- Variación lineal de la presión
- Este no es un proceso realista, pero matemáticamente puede definirse como cualquier otro. Consiste en suponer que la gráfica p(V) es una recta que une los puntos inicial y final
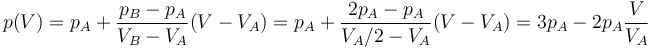
- El trabajo en este proceso equivale al área del trapecio formado por el eje y el segmento que une los dos puntos. El área de este trapecio vale
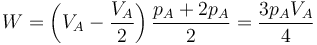
- Este caso se analiza en más detalle en uno de los problemas.
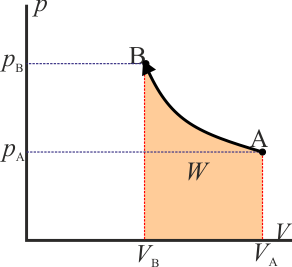
- Proceso isotermo
- En este caso la temperatura final es la misma que la inicial, por lo que podemos imaginar un proceso cuasiestático en el que la temperatura tiene siempre el mismo valor. En este caso el trabajo es igual a
Además de estos cuatro podemos concebir una infinitud más.
6 Procesos cíclicos
El que el trabajo sea una función del camino hace que cuando consideramos un proceso cíclico el trabajo no sea nulo. Un ciclo es un proceso en el que el estado final es el mismo que inicial. En un proceso cíclico todas las variables de estado poseen incrementos nulos
Para el trabajo en cambio, consideramos además del estado inicial/final A algún estado intermedio B. En ese caso el trabajo para ir de A a B por un camino C1 no es el opuesto a volver de B a A por un camino C2 y por tanto el trabajo neto, suma de los dos, no es nulo.
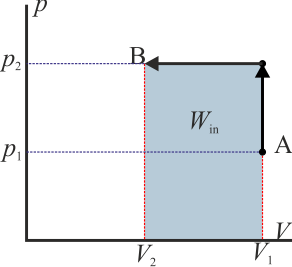
Si se trata de un ciclo cuasiestático podemos representar el proceso mediante una curva cerrada en el diagrama pV.
- Si esta curva se recorre en sentido antihorario quiere decir que el área bajo la curva a la ida es mayor que bajo la curva a la vuelta. La primera representa un trabajo que entra en el sistema mientras que la segunda una que sale de él. Por tanto

- y el sistema está absorbiendo energía en forma de trabajo.
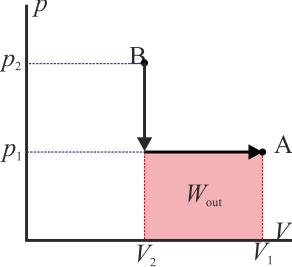
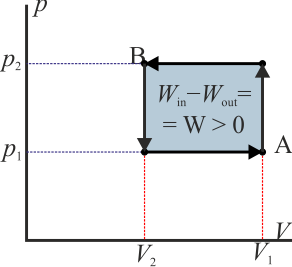
- Si la curva se recorre en sentido horario es la inversa: sale más trabajo del sistema del que entra en él
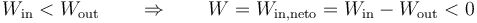
- este sería el esquema típico de una máquina térmica, que realiza un trabajo neto operando cíclicamente.
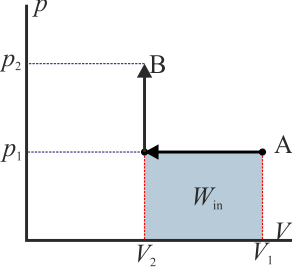
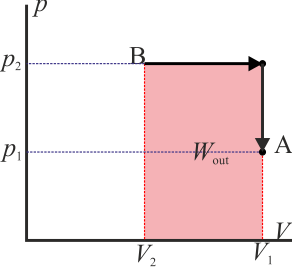
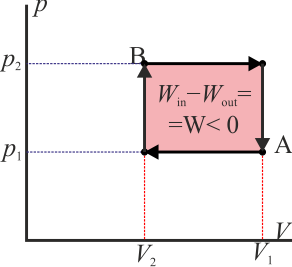
Como ejemplo sencillo, consideremos el gas del apartado anterior. Supongamos que se comprime de forma isóbara y luego se calienta a volumen constante (el primero de los procesos descritos) y luego se le hace regresar calentándolo aun más a presión constante y luego enfriándolo de forma isócora (el segundo de los procesos indicados). En este caso el trabajo neto es
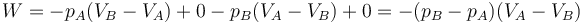
que por supuesto es el área del rectángulo definido por los cuatro segmentos (con el signo opuesto).