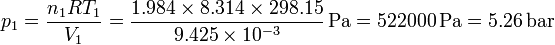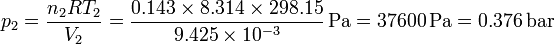Variación de entropía de dos cámaras de gas
De Laplace
1 Enunciado
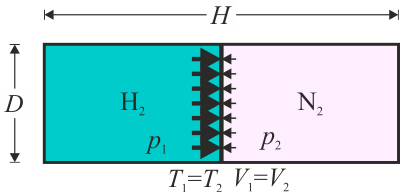
Se tiene un cilindro de 20 cm de diámetro y 60 cm de longitud paredes diatermas en el interior del cual hay dos cámaras de gas. En una hay 4 g de H2 y en la otra 4 g de N2. La temperatura de los dos gases es de 25°C, que también es la temperatura exterior. Separando los dos gases hay un émbolo inicialmente fijado en el centro.
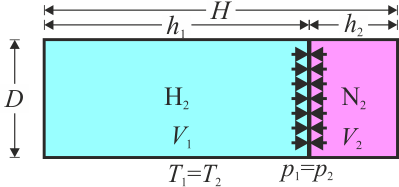
Se libera el pistón y se espera hasta que se vuelva a quedar en equilibrio el sistema. Halle el incremento de entropía de cada gas, del sistema, del entorno y del universo.
Si en vez de liberar el pistón le hacemos un agujero, ¿cuáles son las variaciones de entropía correspondientes?
2 Desplazamiento del pistón
Este problema es una continuación del problema “Tubo con dos cámaras de gas”. Tal como se ve en la solución de dicho problema, inicialmente tenemos diferentes presiones en las cámaras, porque aunque estén a la misma temperatura y ocupen el mismo volumen,
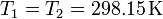
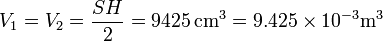
el número de moles de cada gas es diferente. Para el hidrógeno
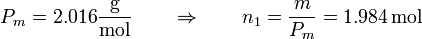
y para el nitrógeno
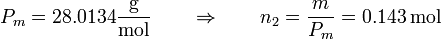
siendo las presiones iniciales