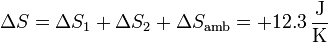Variación de entropía de dos cámaras de gas
De Laplace
1 Enunciado
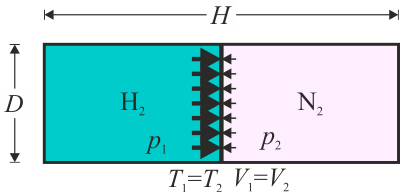
Se tiene un cilindro de 20 cm de diámetro y 60 cm de longitud paredes diatermas en el interior del cual hay dos cámaras de gas. En una hay 4 g de H2 y en la otra 4 g de N2. La temperatura de los dos gases es de 25°C, que también es la temperatura exterior. Separando los dos gases hay un émbolo inicialmente fijado en el centro.
Se libera el pistón y se espera hasta que se vuelva a quedar en equilibrio el sistema. Halle el incremento de entropía de cada gas, del sistema, del entorno y del universo.
Si en vez de liberar el pistón le hacemos un agujero, ¿cuáles son las variaciones de entropía correspondientes?
2 Desplazamiento del pistón
Este problema es una continuación del problema “Tubo con dos cámaras de gas”. Tal como se ve en la solución de dicho problema, inicialmente tenemos diferentes presiones en las cámaras, porque aunque estén a la misma temperatura y ocupen el mismo volumen,
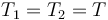
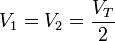
el número de moles de cada gas es diferente, siendo el número de moles de cada uni inversamente proporcional al peso molecular

La presión inicial de cada gas la obtenemos de la ecuación de los gases ideales
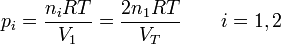
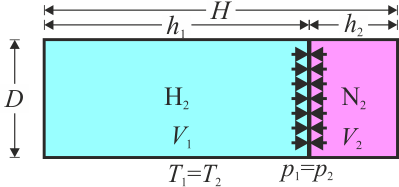
Cuando se deja que se desplace el pistón y se alcanza de nuevo el equilibrio se igualan las presiones
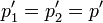
las temperaturas no cambian, por ser las paredes diatermas, y el volumen total sigue siendo el mismo

Sustituyendo aquí la ecuación de los gases ideales
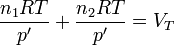
lo que nos da la presión de equilibrio
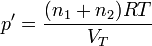
Podemos hallar el incremento de entropía de cada gas empleando la expresión en términos de la temperatura y la presión
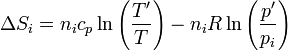
El primer término es nulo. Sustituyendo en el segundo queda
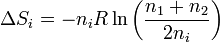
o, en función de los pesos moleculares

Así, la variación de la entropía del hidrógeno es
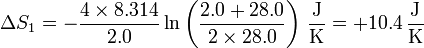
y la del nitrógeno
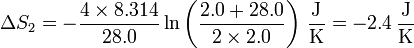
Vemos que la entropía del hidrógeno aumenta al expandirse, y la del nitrógeno disminuye al contraerse.
En este sistema no varía la energía interna (pues la temperatura permanece constante), ni se realiza trabajo (ya que el trabajo es interno, de un gas contra el otro), por lo que no entra calor desde el exterior. Por tanto, la entropía del ambiente no cambia
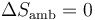
La variación total de la entropía del universo es entonces

que es naturalmente positiva.
3 Perforamiento del pistón
En el segundo caso, cada uno de los gases se expande a todo el volumen, mezclándose, por lo que la variación de la entropía de cada uno es
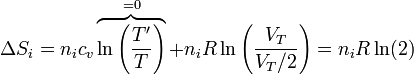
lo que nos da, para el hidrógeno
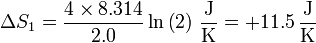
y para el nitrógeno
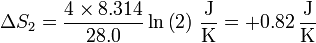
La variación de entropía del ambiente, como antes, es nula. La variación total de entropía es, en este caso