Calor y calorimetría
De Laplace
Contenido |
1 Definición
Sección 2-3 de Çengel & Boles
Una posible definición de calor en termodinámica es la siguiente:
- “El calor es la transferencia de energía a través de la frontera de un sistema debida a una diferencia de temperaturas”
De esta definición, cabe destacar varios aspectos que se detallan en las secciones siguientes y en otros artículos:
- El calor, como el trabajo es una transferencia de energía, un paso de energía de un sitio a otro, no algo que se tiene o se almacena. La frase “hace mucho calor” no es correcta en termodinámica.
- El calor, como el trabajo, habla de lo que pasa en la frontera del sistema, no en su interior. Se debe a la interacción del sistema con su entorno.
- El calor, a diferencia del trabajo, está asociado a la diferencia de temperatura, que es una medida de la agitación de los átomos y moléculas. Por tanto, se debe a la transferencia de energía a través de fenómenos microscópicos (el trabajo se refiere a los macroscópicos).
2 Concepto de calor
A diferencia del trabajo, el calor carece de analogía en mecánica, sino que es un concepto nuevo.
La experiencia nos dice que si colocamos un sistema en un cierto ambiente, el sistema evoluciona. Si colocamos un bloque de hielo al sol, sabemos que se funde. Si ponemos un termómetro de mercurio en la axila de una persona febril, el mercurio se dilata, y si es uno digital, se produce una corriente eléctrica en su interior.
Todos estos cambios se producen sin que haya trabajo asociado, simplemente por contacto. Deducimos entonces que “algo” ha pasado del entorno al sistema y a ese algo lo denominamos “calor”.
Los efectos del calor son varios:
- Cambio en la temperatura del sistema
- Cambio de fase del sistema
- Realización de trabajo
la realización de trabajo como consecuencia de la transferencia de calor se explica al estudiar el primer principio de la termodinámica y el funcionamiento de las máquinas térmicas. En este artículo describiremos los dos primeros efectos.
3 Unidades y signos
El calor es una transferencia de energía y se mide en las mismas unidades que ésta. En el SI, la unidad del calor es el julio (J).
Por razones históricas, se usa también la caloría (cal), definida hoy día como
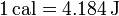
Sin embargo, debido a la existencia de diferentes definiciones de caloría, es preferible no usarla en absoluto. También se usa en medicina, biología y dietética la “caloría grande” (Cal), que en realidad es una kilocaloría ( = 4184 J).
En máquinas térmicas y refrigeradores se usa una unidad británica, la BTU, equivalente a 1055.056 J.
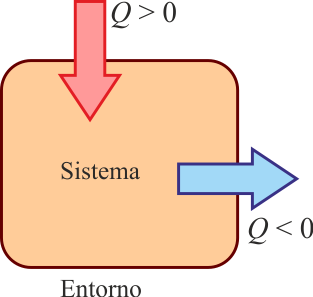
Como criterio para asignar signos al calor se sigue el principio de que:
- Si el calor entra en el sistema se considera positivo.
- Si el calor sale del sistema, es negativo.
Alternativamente, si presuponemos un sentido en el que está fluyendo el calor (calor que entra desde un foco a alta temperatura, o es desechado al ambiente frío), podemos definir
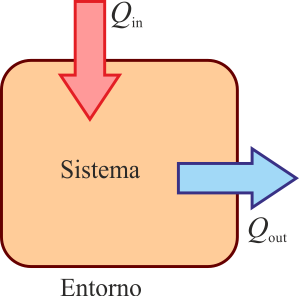
- Qin para el calor que entra en el sistema
- Qout para el calor que sale del sistema
siendo el calor neto intercambiado
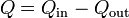
Tanto Qin como Qout pueden resultar negativos. Ello significa que el calor va en el sentido contrario al que habíamos supuesto.
4 Calor e incremento de temperatura
(Sección 4-3 de Çengel & Boles, "Calores específicos")
El primer efecto observable de la transferencia de calor a un sistema es el incremento de su temperatura. Hay que destacar que no siempre que entra calor en un sistema se produce un aumento de temperatura. depende de si también hay cambios de fase o se está realizando trabajo.
Suponiendo que la temperatura sí varía, si la cantidad de calor transferida es pequeña, la variación de temperatura es proporcional a ella, lo que se expresa matemáticamente
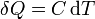
siendo C una propiedad del sistema denominada capacidad calorífica.
El calor diferencial es una diferencial inexacta (por eso expresa con el símbolo “δ”), lo que quiere decir que depende del proceso. Una misma cantidad de calor transferida a un sistema puede producir diferentes incrementos de temperatura, dependiendo de cómo se realice.
Dos casos particulares son importantes. Cuando se transfiere de manera cuasiestática calor a un sistema gaseoso
- si ocurre en un recipiente rígido, tenemos que el volumen es constante y
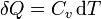
- siendo Cv la capacidad calorífica a volumen constante.
- Si el calor se comunica en un sistema abierto a la atmósfera, o con paredes que pueden moverse libremente, entonces la presión del sistema permanece constante (en un proceso cuasiestático, el sistema estará siempre en un estado de equilibrio mecánico con el exterior) y
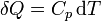
- siendo Cp la capacidad calorífica a presión constante.
Cuando se estudia el efecto del calor en el calentamiento de un sólido o un líquido se presupone que ocurre en un sistema abierto y que por tanto, aunque no se indique se trata de una capacidad calorífica a presión constante.
Las capacidades caloríficas dependen de la temperatura, ya que no cuesta lo mismo elevar la temperatura de agua de 10°C a 11°C (4.193 kJ/kg) que lo que cuesta pasar de 95°C a 96°C (4.213 kJ/kg). Por ello, si queremos realizar un aumento grande de temperatura, es necesario sumar los calores diferenciales.
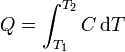
Si, como ocurre a menudo, la capacidad calorífica es aproximadamente constante en un rango de temperaturas, puede extraerse de la integral y escribirse
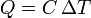
4.1 Capacidad calorífica y calor específico
La Capacidad calorífica es una propiedad del sistema en su conjunto y depende de las propiedades de todas las partes del sistema. Además, como se ha indicado, no tiene el mismo valor para un proceso a presión constante que para uno a volumen constante.
La unidad de la capacidad calorífica es la de una energía dividida por una temperatura, en el SI se mide en J/K (aunque aun existen tablas donde aparece en cal/°C).
En el caso de una sustancia pura (agua, o un gas ideal, o incluso una mezcla de gases como el aire), la capacidad calorífica es una propiedad extensiva, proporcional a la cantidad de sustancia.
A partir de ella se define una propiedad específica: la capacidad calorífica por unidad de masa, más conocida como calor específico

En términos del calor específico, la cantidad de calor necesaria para producir un aumento diferencial de temperatura y uno finito

El calor específico tiene unidades en el SI de J/(kg$middot;K). Su valor, como el de C es dependiente de la temperatura, y tiene un valor diferente según sea un proceso a volumen constante (cv) o a presión constante (cp). Para sólidos y líquidos se suele tabular su valor a presión constante a la presión atmosférica y a una temperatura dada.
Así, su valor para algunas sustancias habituales es
| Sustancia | cp (kJ/kg·K) | Sustancia | cp (kJ/kg·K) | Sustancia | cp (kJ/kg·K) |
|---|---|---|---|---|---|
| Aire seco | 1.012 | Agua (20°C) | 4.18 | Cemento ligero | 0.96 |
| Cobre | 0.385 | Etanol (40°C) | 0.65 | Hielo (0°C) | 2.09 |
| Hierro (20°C) | 0.46 | Madera | 2-3 | Vapor de agua (100°C) | 2.08 |
En la red pueden encontrase más valores para sólidos, líquidos y gases. Para el caso de un gas: sección 4-4.
5 Entalpías de fusión y ebullición
Vienen descritas en el capítulo 3 de Çengel &Boles, junto con todas las propiedades del agua, aunque en mucha mayor extensión de la que se ha impartido en clase.
6 Transferencia de calor
Apéndice del tema 2 de Çengel & Boles (Temas de especial interés)





