Primer principio de la termodinámica (GIE)
De Laplace
(Diferencias entre revisiones)
(→Calor y trabajo en termodinámica) |
(→Calor y trabajo en termodinámica) |
||
| Línea 14: | Línea 14: | ||
* Se miden en las mismas unidades, que en el sistema internacional son julios. Por razones históricas, el calor también se expresa a menudo en calorías. | * Se miden en las mismas unidades, que en el sistema internacional son julios. Por razones históricas, el calor también se expresa a menudo en calorías. | ||
* La principal diferencia es que: | * La principal diferencia es que: | ||
| - | + | ** El trabajo está asociado al cambio de las variables ''macroscópicas'', como pueden ser el volumen, la presión, la posición y velocidad del centro de masas, el voltaje, etc. Se realiza trabajo cuando se acelera un objeto, cambiando la velocidad de su CM. | |
| - | + | ** El calor, a diferencia del trabajo, está asociado a la diferencia de temperatura, que es una medida de la agitación de los átomos y moléculas. Por tanto, se debe a la transferencia de energía a través de fenómenos ''microscópicos''. | |
==Equivalente mecánico del calor== | ==Equivalente mecánico del calor== | ||
Revisión de 11:20 24 mar 2012
Contenido |
1 Calor y trabajo en termodinámica
En los artículos sobre trabajo y calor se dan las definiciones de estas magnitudes en termodinámica:
- Definición de trabajo
- “El trabajo es una transferencia de energía a través de la frontera de un sistema asociada a un cambio en las variables macroscópicas.”
- Definición de calor
- “El calor es la transferencia de energía a través de la frontera de un sistema debida a una diferencia de temperaturas”
Estas dos definiciones tienen bastantes similitudes, pero también algunas importantes diferencias.
- Tanto el trabajo como el calor son transferencias de energía, es decir, son flujos de energía de un sitio a otro, no son algo que se tiene o se almacena.
- Calor y trabajo se localizam en la frontera del sistema, es una entrada o salida por las paredes del sistema, y no se refiere al interior de éste. Sin una parte de un sistema realiza trabajo sobre otra parte del mismo, ello no implica ningún trabajo sobre el sistema. Análogamente con el calor.
- Se miden en las mismas unidades, que en el sistema internacional son julios. Por razones históricas, el calor también se expresa a menudo en calorías.
- La principal diferencia es que:
- El trabajo está asociado al cambio de las variables macroscópicas, como pueden ser el volumen, la presión, la posición y velocidad del centro de masas, el voltaje, etc. Se realiza trabajo cuando se acelera un objeto, cambiando la velocidad de su CM.
- El calor, a diferencia del trabajo, está asociado a la diferencia de temperatura, que es una medida de la agitación de los átomos y moléculas. Por tanto, se debe a la transferencia de energía a través de fenómenos microscópicos.
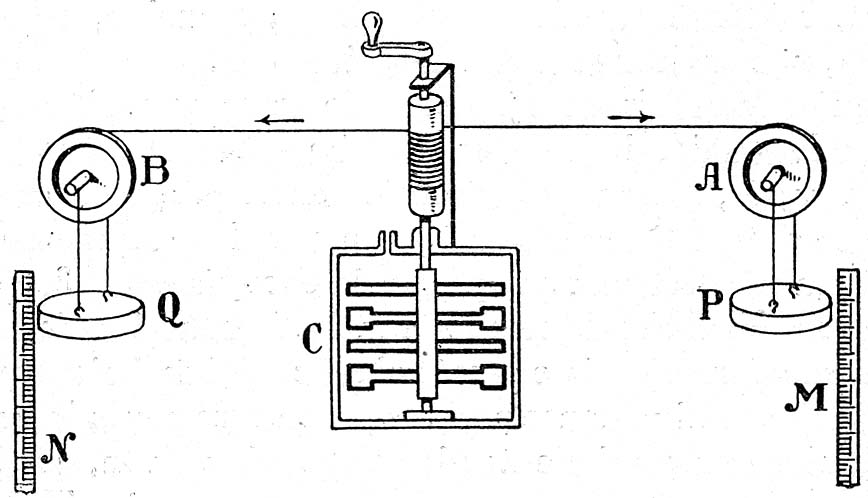
2 Equivalente mecánico del calor
3 Enunciado del primer principio
Sección 2-6 de Çengel & Boles (6ª ed.)
4 Energía total y energía interna
Sección 2-2 de Çengel & Boles
5 Energía de un gas ideal
Sección 4-4 de Çengel & Boles





