Entropía de una mezcla de gases
De Laplace
(→Entropía de un gas ideal) |
(→Entropía de un gas ideal) |
||
| (14 ediciones intermedias no se muestran.) | |||
| Línea 1: | Línea 1: | ||
==Enunciado== | ==Enunciado== | ||
| - | Un recipiente de 2.00 l tiene una barrera que lo divide por la mitad. Una mitad contiene H<sub>2</sub> y la otra O<sub>2</sub>. Ambos gases se encuentran a temperatura | + | Un recipiente de 2.00 l tiene una barrera que lo divide por la mitad. Una mitad contiene H<sub>2</sub> y la otra O<sub>2</sub>. Ambos gases se encuentran a una temperatura de 25°C y a la presión atmosférica. Se retira la barrera de separación, permitiendo que los gases se mezclen. ¿Cuál el aumento de entropía del sistema? |
| - | ==Entropía de un gas | + | ==Entropía de un solo gas== |
| - | + | La variación de la [[Entropía#Gas_ideal|entropía de un gas ideal]] en función de la temperatura y el volumen es | |
| - | <center><math>\ | + | <center><math>\Delta S = nc_V\ln\left(\frac{T_2}{T_1}\right)+nR\ln\left(\frac{V_2}{V_1}\right)</math></center> |
| - | + | y, en función de la temperatura y la presión | |
| + | |||
| + | <center><math>\Delta S = nc_p\ln\left(\frac{T_2}{T_1}\right)-nR\ln\left(\frac{p_2}{p_1}\right)</math></center> | ||
| + | |||
| + | Si tenemos un conjunto de moles de un gas que se expande de un volumen V a un volumen 2V, siendo la temperatura final la misma que la inicial, la variación en la entropía del gas es | ||
| + | |||
| + | <center><math>\Delta S = nc_V\overbrace{\ln\left(\frac{T_2}{T_1}\right)}^{=0}+nR\ln\left(\frac{2V}{V}\right) = nR\,\ln(2)</math></center> | ||
| + | |||
| + | Si usamos como variables la temperatura y la presión (que tienen la ventaja de ser ambas variables intensivas), lo que vemos es que la presión se reduce a la mitad | ||
| + | |||
| + | <center><math>\Delta S = nc_p\overbrace{\ln\left(\frac{T_2}{T_1}\right)}^{=0}-nR\ln\left(\frac{p/2}{p}\right) = nR\,\ln(2)</math></center> | ||
| + | |||
| + | que naturalmente coincide con el resultado anterior. | ||
==Entropía de una mezcla== | ==Entropía de una mezcla== | ||
| + | La entropía es una propiedad extensiva. Para una sustancia pura esto quiere decir que es proporcional a la cantidad de sustancia, esto es, es proporcional a la masa. Para una mezcla de gases ideales, se comportará como lo hace la masa de la mezcla. | ||
| + | Si tenemos N sustancias, con <math>n_i</math> moles de cada una, con una masa molar <math>m_i</math>, la masa total será | ||
| + | <center><math>m = \sum_{i=1}^N n_im_i</math></center> | ||
| + | |||
| + | así que la entropía de la mezcla será | ||
| + | |||
| + | <center><math>S = \sum_{i=1}^N n_is_i</math></center> | ||
| + | |||
| + | siendo <math>s_i</math> la entropía por mol de la sustancia <math>i</math>. Una forma análoga tendremos para el incremento de la entropía. | ||
| + | |||
| + | <center><math>\Delta S = \sum_{i=1}^N n_i\,\Delta s_i</math></center> | ||
| + | |||
| + | El incremento de la entropía molar para cada sustancia será | ||
| + | |||
| + | <center><math>\Delta s_i = \frac{\Delta S_i}{n_i}= c_{pi}\ln\left(\frac{T_i}{T_{i0}}\right)-R\ln\left(\frac{p_{i}}{p_{i0}}\right)</math></center> | ||
| + | |||
| + | donde las <math>p_i</math> son las presiones ''parciales'' de los gases de la mezcla, es decir, | ||
| + | |||
| + | <center><math>p_i = x_i p\,</math>{{qquad}}{{qquad}}<math>x_i = \frac{n_i}{\sum_i n_i}</math></center> | ||
| + | |||
| + | con lo que el incremento de la entropía total es | ||
| + | |||
| + | <center><math>\Delta S = \sum_{i=1}^N\left(n_ic_{p_i}\ln\left(\frac{T_i}{T_{i0}}\right)-n_iR\ln\left(\frac{p_{i}}{p_{i0}}\right)\right)</math></center> | ||
==Incremento de entropía== | ==Incremento de entropía== | ||
| + | En nuestro caso, la temperatura inicial es la misma que la final para los dos gases. | ||
| + | |||
| + | <center><math>T_{i}=T_{i0}\,</math>{{tose}}<math>\ln\left(\frac{T_i}{T_{i0}}\right)=0</math></center> | ||
| + | |||
| + | Lo mismo ocurre con la presión ''total'' ('''no''' con la parcial), ya que inicialmente ambos se encontraban a la misma y al romper la membrana se redistribuyen las moléculas, pero el número de moles total y el volumen total sigue siendo el mismo. | ||
| + | |||
| + | <center><math>p_{i0}=p\,</math></center> | ||
| + | |||
| + | Las presiones parciales sí se ven reducidas pues cada gas pasa a ocupar el volumen total, con el mismo número de moles. las presiones parciales serán | ||
| + | |||
| + | <center><math>p_i = x_i p = x_i p_{i0}\,</math></center> | ||
| + | |||
| + | Todo esto deja el aumento de entropía en | ||
| + | |||
| + | <center><math>\Delta S = \sum_i n_ic_{pi}\overbrace{\ln\left(\frac{T_i}{T_{i0}}\right)}^{=0}-\sum_i n_i R \ln\left(\frac{p_i}{p_{i0}}\right) = -\sum_i n_i R \ln\left(x_i\right)</math></center> | ||
| + | |||
| + | Aplicando la ley de los gases ideales | ||
| + | |||
| + | <center><math>\Delta S = -\sum_i\frac{p_iV}{T}\ln(x_i) = -\frac{pV}{T}\left(x_{O_2}\ln(x_{O_2})+x_{H_2}\ln(x_{H_2})\right)</math></center> | ||
| + | |||
| + | En nuestro caso, las fracciones molares de los dos gases son la misma: un 50%, ya que a igualdad de presión, volumen y temperaturas iniciales les corresponde el mismo número de moles (nótese que no necesitamos calcular cuántos son estos moles). | ||
| + | |||
| + | <center><math>x_{O_2}=x_{H_2} = \frac{1}{2}</math>{{tose}}<math>\Delta S = -\frac{1\,\mathrm{atm}\cdot 2\,\mathrm{l}}{298\,\mathrm{K}}(2\times(0.5\ln(0.5))\cdot\frac{101.325\,\mathrm{J}}{1\,\mathrm{atm}\cdot\mathrm{l}} = 0.471\,\frac{\mathrm{J}}{\mathrm{K}}</math></center> | ||
| + | |||
| + | Vemos que la entropía del universo aumenta, ya que la del sistema lo hace y la del ambiente no se ve afectada (no hay intercambio de calor con el exterior). Por ello, este proceso de mezcla es espontáneo e irreversible. | ||
[[Categoría:Problemas del segundo principio de la termodinámica]] | [[Categoría:Problemas del segundo principio de la termodinámica]] | ||
última version al 12:18 17 may 2009
Contenido |
1 Enunciado
Un recipiente de 2.00 l tiene una barrera que lo divide por la mitad. Una mitad contiene H2 y la otra O2. Ambos gases se encuentran a una temperatura de 25°C y a la presión atmosférica. Se retira la barrera de separación, permitiendo que los gases se mezclen. ¿Cuál el aumento de entropía del sistema?
2 Entropía de un solo gas
La variación de la entropía de un gas ideal en función de la temperatura y el volumen es
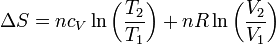
y, en función de la temperatura y la presión
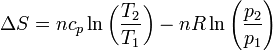
Si tenemos un conjunto de moles de un gas que se expande de un volumen V a un volumen 2V, siendo la temperatura final la misma que la inicial, la variación en la entropía del gas es
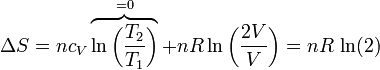
Si usamos como variables la temperatura y la presión (que tienen la ventaja de ser ambas variables intensivas), lo que vemos es que la presión se reduce a la mitad
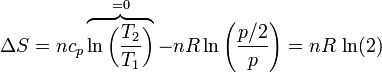
que naturalmente coincide con el resultado anterior.
3 Entropía de una mezcla
La entropía es una propiedad extensiva. Para una sustancia pura esto quiere decir que es proporcional a la cantidad de sustancia, esto es, es proporcional a la masa. Para una mezcla de gases ideales, se comportará como lo hace la masa de la mezcla.
Si tenemos N sustancias, con ni moles de cada una, con una masa molar mi, la masa total será
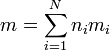
así que la entropía de la mezcla será
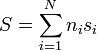
siendo si la entropía por mol de la sustancia i. Una forma análoga tendremos para el incremento de la entropía.
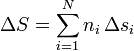
El incremento de la entropía molar para cada sustancia será
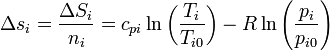
donde las pi son las presiones parciales de los gases de la mezcla, es decir,
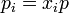
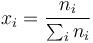
con lo que el incremento de la entropía total es
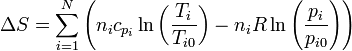
4 Incremento de entropía
En nuestro caso, la temperatura inicial es la misma que la final para los dos gases.


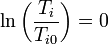
Lo mismo ocurre con la presión total (no con la parcial), ya que inicialmente ambos se encontraban a la misma y al romper la membrana se redistribuyen las moléculas, pero el número de moles total y el volumen total sigue siendo el mismo.
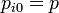
Las presiones parciales sí se ven reducidas pues cada gas pasa a ocupar el volumen total, con el mismo número de moles. las presiones parciales serán
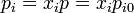
Todo esto deja el aumento de entropía en
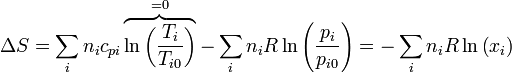
Aplicando la ley de los gases ideales
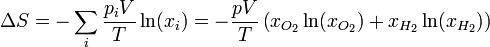
En nuestro caso, las fracciones molares de los dos gases son la misma: un 50%, ya que a igualdad de presión, volumen y temperaturas iniciales les corresponde el mismo número de moles (nótese que no necesitamos calcular cuántos son estos moles).
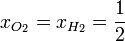

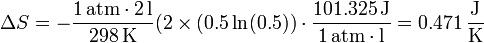
Vemos que la entropía del universo aumenta, ya que la del sistema lo hace y la del ambiente no se ve afectada (no hay intercambio de calor con el exterior). Por ello, este proceso de mezcla es espontáneo e irreversible.





