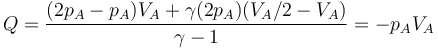Calor y calorimetría
De Laplace
(→Transferencia de calor) |
(→Transferencia de calor) |
||
| (93 ediciones intermedias no se muestran.) | |||
| Línea 8: | Línea 8: | ||
De esta definición, cabe destacar varios aspectos que se detallan en las secciones siguientes y en otros artículos: | De esta definición, cabe destacar varios aspectos que se detallan en las secciones siguientes y en otros artículos: | ||
| - | *El calor, como el [[Trabajo en termodinámica (GIE)|trabajo]] es una ''transferencia'' de energía, un paso de energía de un sitio a otro, no algo que se tiene o se almacena. La frase “hace mucho calor” no es correcta en termodinámica. | + | *El calor, como el [[Trabajo en termodinámica (GIE)|trabajo]], es una ''transferencia'' de energía, un paso de energía de un sitio a otro, no algo que se tiene o se almacena. La frase “hace mucho calor” no es correcta en termodinámica. |
* El calor, como el trabajo, habla de lo que pasa en la frontera del sistema, no en su interior. Se debe a la interacción del sistema con su entorno. | * El calor, como el trabajo, habla de lo que pasa en la frontera del sistema, no en su interior. Se debe a la interacción del sistema con su entorno. | ||
* El calor, a diferencia del trabajo, está asociado a la diferencia de temperatura, que es una medida de la agitación de los átomos y moléculas. Por tanto, se debe a la transferencia de energía a través de fenómenos microscópicos (el trabajo se refiere a los macroscópicos). | * El calor, a diferencia del trabajo, está asociado a la diferencia de temperatura, que es una medida de la agitación de los átomos y moléculas. Por tanto, se debe a la transferencia de energía a través de fenómenos microscópicos (el trabajo se refiere a los macroscópicos). | ||
==Concepto de calor== | ==Concepto de calor== | ||
| - | A diferencia del trabajo, el calor carece de analogía en mecánica | + | A diferencia del trabajo, el calor carece de analogía en mecánica. Se trata de un concepto nuevo. |
La experiencia nos dice que si colocamos un sistema en un cierto ambiente, el sistema evoluciona. Si colocamos un bloque de hielo al sol, sabemos que se funde. Si ponemos un termómetro de mercurio en la axila de una persona febril, el mercurio se dilata, y si es uno digital, se produce una corriente eléctrica en su interior. | La experiencia nos dice que si colocamos un sistema en un cierto ambiente, el sistema evoluciona. Si colocamos un bloque de hielo al sol, sabemos que se funde. Si ponemos un termómetro de mercurio en la axila de una persona febril, el mercurio se dilata, y si es uno digital, se produce una corriente eléctrica en su interior. | ||
| Línea 52: | Línea 52: | ||
siendo el calor neto intercambiado | siendo el calor neto intercambiado | ||
| - | <center><math>Q=Q_\mathrm{in}-Q_\mathrm{out}\,</math></center> | + | <center><math>Q=Q_\mathrm{in,neto}=Q_\mathrm{in}-Q_\mathrm{out}\,</math></center> |
Tanto <math>Q_\mathrm{in}</math> como <math>Q_\mathrm{out}</math> pueden resultar negativos. Ello significa que el calor va en el sentido contrario al que habíamos supuesto. | Tanto <math>Q_\mathrm{in}</math> como <math>Q_\mathrm{out}</math> pueden resultar negativos. Ello significa que el calor va en el sentido contrario al que habíamos supuesto. | ||
| Línea 64: | Línea 64: | ||
El criterio de signos para el flujo de calor es el mismo que para el calor. Si está entrando calor en el sistema el flujo es positivo; si sale de él, es negativo. | El criterio de signos para el flujo de calor es el mismo que para el calor. Si está entrando calor en el sistema el flujo es positivo; si sale de él, es negativo. | ||
| + | |||
| + | Del mismo modo, podemos definir un flujo de calor hacia dentro o hacia afuera del sistema | ||
| + | |||
| + | <center><math>\dot{Q}_\mathrm{in}=\frac{\delta Q_\mathrm{in}}{\mathrm{d}t}\qquad\qquad\dot{Q}_\mathrm{out}=\frac{\delta Q_\mathrm{out}}{\mathrm{d}t}\qquad\qquad\dot{Q}=\dot{Q}_\mathrm{in}-\dot{Q}_\mathrm{out}</math></center> | ||
==Calor por unidad de masa== | ==Calor por unidad de masa== | ||
| Línea 72: | Línea 76: | ||
El calor por unidad de masa se mide en el SI en J/kg. | El calor por unidad de masa se mide en el SI en J/kg. | ||
| + | ==Efecto del calor en un sistema== | ||
| + | De entre los efectos del calor sobre un sistema, hay tres especialmente destacados: | ||
| + | * El cambio de temperatura en el sistema. | ||
| + | * El cambio de fase de las sustancias | ||
| + | * La realización de trabajo, mecánico o de otro tipo. | ||
| + | Hay que destacar que el primer efecto, el cambio de temperatura, no siempre ocurre. Es perfectamente posible que en un sistema entre calor y la temperatura del sistema no cambie o incluso baje. Dependerá de si simultáneamente existe realización de trabajo o un posible cambio de fase. | ||
==Calor e incremento de temperatura== | ==Calor e incremento de temperatura== | ||
(Sección 4-3 de Çengel & Boles, "Calores específicos") | (Sección 4-3 de Çengel & Boles, "Calores específicos") | ||
| - | El primer efecto observable de la transferencia de calor a un sistema es el incremento de su temperatura. Hay que destacar que no siempre que entra calor en un sistema se produce un aumento de temperatura | + | El primer efecto observable de la transferencia de calor a un sistema es el incremento de su temperatura. Hay que destacar que no siempre que entra calor en un sistema se produce un aumento de temperatura, depende de si también hay cambios de fase o se está realizando trabajo. |
Suponiendo que la temperatura sí varía, si la cantidad de calor transferida es pequeña, la variación de temperatura es proporcional a ella, lo que se expresa matemáticamente | Suponiendo que la temperatura sí varía, si la cantidad de calor transferida es pequeña, la variación de temperatura es proporcional a ella, lo que se expresa matemáticamente | ||
| Línea 81: | Línea 91: | ||
<center><math>\delta Q = C\,\mathrm{d}T</math></center> | <center><math>\delta Q = C\,\mathrm{d}T</math></center> | ||
| - | siendo <math>C</math> una propiedad del sistema denominada ''capacidad calorífica''. | + | siendo <math>C</math> una propiedad del sistema denominada ''capacidad calorífica''. De la definición se tiene que la capacidad calorífica se mide en el SI en J/K. |
El calor diferencial es una diferencial inexacta (por eso expresa con el símbolo “δ”), lo que quiere decir que depende del proceso. Una misma cantidad de calor transferida a un sistema puede producir diferentes incrementos de temperatura, dependiendo de cómo se realice. | El calor diferencial es una diferencial inexacta (por eso expresa con el símbolo “δ”), lo que quiere decir que depende del proceso. Una misma cantidad de calor transferida a un sistema puede producir diferentes incrementos de temperatura, dependiendo de cómo se realice. | ||
| Línea 99: | Línea 109: | ||
:siendo <math>C_p</math> la ''capacidad calorífica a presión constante''. | :siendo <math>C_p</math> la ''capacidad calorífica a presión constante''. | ||
| - | Cuando se estudia el efecto del calor en el calentamiento de un sólido o un líquido se presupone que ocurre en un sistema abierto y que por tanto, aunque no se indique se trata de una capacidad calorífica a presión constante. | + | Cuando se estudia el efecto del calor en el calentamiento de un sólido o un líquido se presupone que ocurre en un sistema abierto y que por tanto, aunque no se indique, se trata de una capacidad calorífica a presión constante. |
Las capacidades caloríficas dependen de la temperatura, ya que no cuesta lo mismo elevar la temperatura de agua de 10°C a 11°C (4.193 kJ/kg) que lo que cuesta pasar de 95°C a 96°C (4.213 kJ/kg). Por ello, si queremos realizar un aumento grande de temperatura, es necesario sumar los calores diferenciales. | Las capacidades caloríficas dependen de la temperatura, ya que no cuesta lo mismo elevar la temperatura de agua de 10°C a 11°C (4.193 kJ/kg) que lo que cuesta pasar de 95°C a 96°C (4.213 kJ/kg). Por ello, si queremos realizar un aumento grande de temperatura, es necesario sumar los calores diferenciales. | ||
| Línea 109: | Línea 119: | ||
<center><math>Q = C\,\Delta T</math></center> | <center><math>Q = C\,\Delta T</math></center> | ||
| + | Cuando la capacidad calorífica es constante, podemos representar gráficamente la relación entre calor absorbido y aumento de temperatura mediante una línea recta. Despejando tenemos | ||
| + | |||
| + | <center><math>\Delta T = \frac{1}{C}Q\qquad\Rightarrow\qquad T = T_0+\frac{1}{C}Q</math></center> | ||
| + | |||
| + | <center>[[Archivo:capacidad-calorifica-01.png]]</center> | ||
| + | |||
| + | El que la capacidad vaya en el denominador quiere decir que cuanto mayor es la capacidad calorífica, menor es la variación de temperatura para un valor dado del calor. | ||
| + | |||
| + | Cuando la capacidad calorífica no es constante, en lugar de una recta tendremos una curva. | ||
===Capacidad calorífica y calor específico=== | ===Capacidad calorífica y calor específico=== | ||
| - | La | + | La capacidad calorífica es una propiedad del sistema en su conjunto y depende de las propiedades de todas las partes del sistema. Además, como se ha indicado, no tiene el mismo valor para un proceso a presión constante que para uno a volumen constante. |
La unidad de la capacidad calorífica es la de una energía dividida por una temperatura, en el SI se mide en J/K (aunque aun existen tablas donde aparece en cal/°C). | La unidad de la capacidad calorífica es la de una energía dividida por una temperatura, en el SI se mide en J/K (aunque aun existen tablas donde aparece en cal/°C). | ||
| Línea 124: | Línea 143: | ||
<center><math>\delta Q = mc\,\mathrm{d}T\qquad\qquad Q = \int_{T_1}^{T_2}mc\,\mathrm{d}T\simeq mc\,\Delta T</math></center> | <center><math>\delta Q = mc\,\mathrm{d}T\qquad\qquad Q = \int_{T_1}^{T_2}mc\,\mathrm{d}T\simeq mc\,\Delta T</math></center> | ||
| - | El calor específico tiene unidades en el SI de J/(kg | + | El calor específico tiene unidades en el SI de J/(kg·K). Su valor, como el de <math>C</math> es dependiente de la temperatura, y tiene un valor diferente según sea un proceso a volumen constante (<math>c_v</math>) o a presión constante (<math>c_p</math>). Para sólidos y líquidos se suele tabular su valor a presión constante a la presión atmosférica y a una temperatura dada. |
Así, su valor para algunas sustancias habituales es | Así, su valor para algunas sustancias habituales es | ||
| Línea 161: | Línea 180: | ||
En la red pueden encontrase más valores para [http://www.engineeringtoolbox.com/specific-heat-solids-d_154.html sólidos], [http://www.engineeringtoolbox.com/specific-heat-fluids-d_151.html líquidos] y [http://www.engineeringtoolbox.com/spesific-heat-capacity-gases-d_159.html gases]. | En la red pueden encontrase más valores para [http://www.engineeringtoolbox.com/specific-heat-solids-d_154.html sólidos], [http://www.engineeringtoolbox.com/specific-heat-fluids-d_151.html líquidos] y [http://www.engineeringtoolbox.com/spesific-heat-capacity-gases-d_159.html gases]. | ||
| + | |||
| + | ====Calor específico del agua==== | ||
En el caso del [http://www.engineeringtoolbox.com/water-thermal-properties-d_162.html agua] su valor comienza por 4.204 kJ/(kg·K) a 0°C, baja hasta 4.178 a 35°C y vuelve a aumentar hasta 4.219 a 100°C. A temperatura ambiente, un valor de 4.18, con solo dos cifras decimales, suele ser más que suficiente. | En el caso del [http://www.engineeringtoolbox.com/water-thermal-properties-d_162.html agua] su valor comienza por 4.204 kJ/(kg·K) a 0°C, baja hasta 4.178 a 35°C y vuelve a aumentar hasta 4.219 a 100°C. A temperatura ambiente, un valor de 4.18, con solo dos cifras decimales, suele ser más que suficiente. | ||
| - | Así para calentar 1kg de agua desde 0°C a 100°C, usando el valor anterior se necesitan | + | Un valor más preciso puede sacarse interpolando los valores y resulta la tabla |
| + | |||
| + | {| class="bordeado" | ||
| + | |- | ||
| + | ! <math>t_C</math> (0°C) | ||
| + | ! <math>c_p</math> (kJ/kg·mol) | ||
| + | ! <math>t_C</math> (0°C) | ||
| + | ! <math>c_p</math> (kJ/kg·mol) | ||
| + | ! <math>t_C</math> (0°C) | ||
| + | ! <math>c_p</math> (kJ/kg·mol) | ||
| + | ! <math>t_C</math> (0°C) | ||
| + | ! <math>c_p</math> (kJ/kg·mol) | ||
| + | |- | ||
| + | |||
| + | |0 | ||
| + | |||
| + | |4.224 | ||
| + | |||
| + | |25 | ||
| + | |||
| + | |4.184 | ||
| + | |||
| + | |50 | ||
| + | |||
| + | |4.179 | ||
| + | |||
| + | |75 | ||
| + | |||
| + | |4.192 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |1 | ||
| + | |||
| + | |4.221 | ||
| + | |||
| + | |26 | ||
| + | |||
| + | |4.183 | ||
| + | |||
| + | |51 | ||
| + | |||
| + | |4.179 | ||
| + | |||
| + | |76 | ||
| + | |||
| + | |4.193 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |2 | ||
| + | |||
| + | |4.219 | ||
| + | |||
| + | |27 | ||
| + | |||
| + | |4.183 | ||
| + | |||
| + | |52 | ||
| + | |||
| + | |4.179 | ||
| + | |||
| + | |77 | ||
| + | |||
| + | |4.194 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |3 | ||
| + | |||
| + | |4.216 | ||
| + | |||
| + | |28 | ||
| + | |||
| + | |4.182 | ||
| + | |||
| + | |53 | ||
| + | |||
| + | |4.179 | ||
| + | |||
| + | |78 | ||
| + | |||
| + | |4.195 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |4 | ||
| + | |||
| + | |4.214 | ||
| + | |||
| + | |29 | ||
| + | |||
| + | |4.181 | ||
| + | |||
| + | |54 | ||
| + | |||
| + | |4.180 | ||
| + | |||
| + | |79 | ||
| + | |||
| + | |4.195 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |5 | ||
| + | |||
| + | |4.212 | ||
| + | |||
| + | |30 | ||
| + | |||
| + | |4.181 | ||
| + | |||
| + | |55 | ||
| + | |||
| + | |4.180 | ||
| + | |||
| + | |80 | ||
| + | |||
| + | |4.196 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |6 | ||
| + | |||
| + | |4.210 | ||
| + | |||
| + | |31 | ||
| + | |||
| + | |4.180 | ||
| + | |||
| + | |56 | ||
| + | |||
| + | |4.180 | ||
| + | |||
| + | |81 | ||
| + | |||
| + | |4.197 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |7 | ||
| + | |||
| + | |4.208 | ||
| + | |||
| + | |32 | ||
| + | |||
| + | |4.180 | ||
| + | |||
| + | |57 | ||
| + | |||
| + | |4.181 | ||
| + | |||
| + | |82 | ||
| + | |||
| + | |4.198 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |8 | ||
| + | |||
| + | |4.206 | ||
| + | |||
| + | |33 | ||
| + | |||
| + | |4.179 | ||
| + | |||
| + | |58 | ||
| + | |||
| + | |4.181 | ||
| + | |||
| + | |83 | ||
| + | |||
| + | |4.199 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |9 | ||
| + | |||
| + | |4.204 | ||
| + | |||
| + | |34 | ||
| + | |||
| + | |4.179 | ||
| + | |||
| + | |59 | ||
| + | |||
| + | |4.182 | ||
| + | |||
| + | |84 | ||
| + | |||
| + | |4.200 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |10 | ||
| + | |||
| + | |4.202 | ||
| + | |||
| + | |35 | ||
| + | |||
| + | |4.179 | ||
| + | |||
| + | |60 | ||
| + | |||
| + | |4.182 | ||
| + | |||
| + | |85 | ||
| + | |||
| + | |4.201 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |11 | ||
| + | |||
| + | |4.201 | ||
| + | |||
| + | |36 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |61 | ||
| + | |||
| + | |4.183 | ||
| + | |||
| + | |86 | ||
| + | |||
| + | |4.202 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |12 | ||
| + | |||
| + | |4.199 | ||
| + | |||
| + | |37 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |62 | ||
| + | |||
| + | |4.183 | ||
| + | |||
| + | |87 | ||
| + | |||
| + | |4.203 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |13 | ||
| + | |||
| + | |4.197 | ||
| + | |||
| + | |38 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |63 | ||
| + | |||
| + | |4.184 | ||
| + | |||
| + | |88 | ||
| + | |||
| + | |4.204 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |14 | ||
| + | |||
| + | |4.196 | ||
| + | |||
| + | |39 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |64 | ||
| + | |||
| + | |4.184 | ||
| + | |||
| + | |89 | ||
| + | |||
| + | |4.205 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |15 | ||
| + | |||
| + | |4.194 | ||
| + | |||
| + | |40 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |65 | ||
| + | |||
| + | |4.185 | ||
| + | |||
| + | |90 | ||
| + | |||
| + | |4.206 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |16 | ||
| + | |||
| + | |4.193 | ||
| + | |||
| + | |41 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |66 | ||
| + | |||
| + | |4.186 | ||
| + | |||
| + | |91 | ||
| + | |||
| + | |4.208 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |17 | ||
| + | |||
| + | |4.192 | ||
| + | |||
| + | |42 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |67 | ||
| + | |||
| + | |4.186 | ||
| + | |||
| + | |92 | ||
| + | |||
| + | |4.209 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |18 | ||
| + | |||
| + | |4.191 | ||
| + | |||
| + | |43 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |68 | ||
| + | |||
| + | |4.187 | ||
| + | |||
| + | |93 | ||
| + | |||
| + | |4.210 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |19 | ||
| + | |||
| + | |4.190 | ||
| + | |||
| + | |44 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |69 | ||
| + | |||
| + | |4.188 | ||
| + | |||
| + | |94 | ||
| + | |||
| + | |4.211 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |20 | ||
| + | |||
| + | |4.188 | ||
| + | |||
| + | |45 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |70 | ||
| + | |||
| + | |4.188 | ||
| + | |||
| + | |95 | ||
| + | |||
| + | |4.212 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |21 | ||
| + | |||
| + | |4.187 | ||
| + | |||
| + | |46 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |71 | ||
| + | |||
| + | |4.189 | ||
| + | |||
| + | |96 | ||
| + | |||
| + | |4.213 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |22 | ||
| + | |||
| + | |4.186 | ||
| + | |||
| + | |47 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |72 | ||
| + | |||
| + | |4.190 | ||
| + | |||
| + | |97 | ||
| + | |||
| + | |4.215 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |23 | ||
| + | |||
| + | |4.186 | ||
| + | |||
| + | |48 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |73 | ||
| + | |||
| + | |4.190 | ||
| + | |||
| + | |98 | ||
| + | |||
| + | |4.216 | ||
| + | |||
| + | |- | ||
| + | |||
| + | |24 | ||
| + | |4.185 | ||
| + | |||
| + | |49 | ||
| + | |||
| + | |4.178 | ||
| + | |||
| + | |74 | ||
| + | |||
| + | |4.191 | ||
| + | |||
| + | |99 | ||
| + | |||
| + | |4.217 | ||
| + | |||
| + | |} | ||
| + | |||
| + | (Fuente [http://webbook.nist.gov/cgi/cbook.cgi?ID=C7732185&Mask=2&Type=JANAFL&Plot=on#JANAFL NIST] y elaboración propia) | ||
| + | |||
| + | <center>[[Archivo:cpT.png|400px]]</center> | ||
| + | |||
| + | |||
| + | Así para calentar 1kg de agua desde 0°C a 100°C, usando el valor promedio anterior se necesitan | ||
| - | <center><math>Q = mc\,\Delta T = 4.18\times 100\,\mathrm{kJ} = 418\,\mathrm{kJ}</math></center> | + | <center><math>Q = mc\,\Delta T = 4.18\times 100\,\mathrm{kJ} = 418\,\mathrm{kJ}\,</math></center> |
| - | Un valor más exacto, usando la tabla de la referencia anterior y considerando incrementos de 5°C en 5°C nos da un calor | + | Un valor más exacto, usando la tabla de la referencia anterior y considerando incrementos de 5°C en 5°C nos da un calor ligeramente superior. El error, aunque apreciable, es de solo el 1%. Este error se reduce aun más si consideramos incrementos menores de temperatura. |
===Capacidad calorífica molar=== | ===Capacidad calorífica molar=== | ||
(Çengel & Boles: sección 4-4) | (Çengel & Boles: sección 4-4) | ||
| - | En el caso de un gas, en lugar de la capacidad específica por unidad de masa se suele usar la capacidad calorífica molar, denotada también con c | + | En el caso de un gas, en lugar de la capacidad específica por unidad de masa se suele usar la capacidad calorífica molar, denotada también con c minúscula |
<center><math>c = \frac{C}{n}</math></center> | <center><math>c = \frac{C}{n}</math></center> | ||
| Línea 264: | Línea 753: | ||
<center><math>\frac{c_p}{R}-\frac{c_v}{R}\simeq 1\qquad\Rightarrow\qquad c_p-c_v\simeq R</math></center> | <center><math>\frac{c_p}{R}-\frac{c_v}{R}\simeq 1\qquad\Rightarrow\qquad c_p-c_v\simeq R</math></center> | ||
| + | :esta propiedad se conoce como ''ley de Mayer''. | ||
* Para los gases nobles (monoatómicos) se verifica casi exactamente | * Para los gases nobles (monoatómicos) se verifica casi exactamente | ||
<center><math>c_v=\frac{3}{2}R\qquad c_p = \frac{5}{2}R</math></center> | <center><math>c_v=\frac{3}{2}R\qquad c_p = \frac{5}{2}R</math></center> | ||
| - | * Para los gases diatómicos ( | + | * Para los gases diatómicos (N<sub>2</sub>, H<sub>2</sub>, O<sub>2</sub>) se cumple, pero con menor aproximación |
<center><math>c_v\simeq\frac{5}{2}R\qquad c_p \simeq \frac{7}{2}R</math></center> | <center><math>c_v\simeq\frac{5}{2}R\qquad c_p \simeq \frac{7}{2}R</math></center> | ||
| - | * Para los gases de más átomos (agua o | + | * Para los gases de más átomos (agua o CO<sub>2</sub>, por ejemplo) no existe una fórmula sencilla para los valores de <math>c_p</math> y <math>c_v</math>. |
| - | En el caso del aire, al tratarse de una mezcla de gases y no de una sustancia pura, hay que tener cuidado al definir el concepto molar. Puede medirse experimentalmente el valor de los calores específicos (por unidad de masa) y luego considerar el gas como una sustancia con peso molecular el medio de sus componentes | + | En el caso del aire seco, al tratarse de una mezcla de gases y no de una sustancia pura, hay que tener cuidado al definir el concepto molar. Puede medirse experimentalmente el valor de los calores específicos (por unidad de masa) y luego considerar el gas como una sustancia con peso molecular el medio de sus componentes |
<center><math>P_{m\mathrm{(aire)}} \simeq 0.78P_{m\mathrm{(N_2)}}+0.21P_{m\mathrm{(O_2)}}+0.01P_{m\mathrm{(Ar)}} = 28.96\,\frac{\mathrm{g}}{\mathrm{mol}}</math></center> | <center><math>P_{m\mathrm{(aire)}} \simeq 0.78P_{m\mathrm{(N_2)}}+0.21P_{m\mathrm{(O_2)}}+0.01P_{m\mathrm{(Ar)}} = 28.96\,\frac{\mathrm{g}}{\mathrm{mol}}</math></center> | ||
| Línea 312: | Línea 802: | ||
<center><math>c_v = \frac{R}{\gamma-1}\qquad\qquad c_p = \frac{\gamma R}{\gamma-1}</math></center> | <center><math>c_v = \frac{R}{\gamma-1}\qquad\qquad c_p = \frac{\gamma R}{\gamma-1}</math></center> | ||
| + | |||
| + | {{ejemplo|'''Calentamiento de aire seco''' | ||
Según estos datos, si tenemos inicialmente 0.1 m³ de aire a 300K y 100 kPa y queremos calentarlo hasta 600K manteniendo constante su volumen debemos introducir un calor | Según estos datos, si tenemos inicialmente 0.1 m³ de aire a 300K y 100 kPa y queremos calentarlo hasta 600K manteniendo constante su volumen debemos introducir un calor | ||
| - | <center><math>Q = nc_v\,\Delta T\qquad\qquad n = \frac{p_1V_1}{RT_1}= \frac{10^5\times 0.1}{8.314\times 300}\mathrm{mol} = 4.01\,\mathrm{mol}\qquad\Rightarrow\qquad Q = 4.01\times 20.8\times(600-300)\,\mathrm{J}=25.1\,\mathrm{kJ}</math></center> | + | <center><math>Q = nc_v\,\Delta T\qquad\qquad n = \frac{p_1V_1}{RT_1}= \frac{10^5\times 0.1}{8.314\times 300}\mathrm{mol} = 4.01\,\mathrm{mol}\qquad\Rightarrow\qquad Q = 4.01\times 20.8\times(600-300)\,\mathrm{J}=25.1\,\mathrm{kJ}\,</math></center> |
mientras que si lo que mantenemos constante es la presión | mientras que si lo que mantenemos constante es la presión | ||
| - | <center><math>Q = nc_p\,\Delta T = 4.01\times 29.2\times(600-300)\,\mathrm{J}=35.1\,\mathrm{kJ}</math></center> | + | <center><math>Q = nc_p\,\Delta T = 4.01\times 29.2\times(600-300)\,\mathrm{J}=35.1\,\mathrm{kJ}\,</math></center> |
| + | }} | ||
En general se necesita más calor para realizar un calentamiento a presión constante que uno a volumen constante. | En general se necesita más calor para realizar un calentamiento a presión constante que uno a volumen constante. | ||
| + | |||
| + | ====Calor en función de la presión y el volumen==== | ||
| + | Para el caso de un gas ideal, pueden obtenerse expresiones alternativas para el calor que no requiere el cálculo de la temperatura ni el uso del número de moles. | ||
| + | |||
| + | ;A volumen constante: Aplicamos la proporcionalidad entre <math>c_v</math> y <math>R</math> | ||
| + | |||
| + | <center><math>Q_{A\to B}=nc_v(T_B-T_A) = \frac{nRT_B-nRT_A}{\gamma-1}=\frac{p_BV_B-p_AV_A}{\gamma-1}=\frac{(p_B-p_A)V}{\gamma-1}=\frac{V\,\Delta p}{\gamma-1}</math></center> | ||
| + | |||
| + | ;A presión constante: Aplicamos la proporcionalidad entre <math>c_p</math> y <math>R</math> | ||
| + | |||
| + | <center><math>Q_{A\to B}=nc_p(T_B-T_A) = \frac{\gamma(nRT_B-nRT_A)}{\gamma-1}=\frac{\gamma(p_BV_B-p_AV_A)}{\gamma-1}=\frac{\gamma p(V_B-V_A)}{\gamma-1}=\frac{\gamma\,p\,\Delta V}{\gamma-1}</math></center> | ||
==Calor y cambios de fase== | ==Calor y cambios de fase== | ||
| Línea 330: | Línea 834: | ||
Una vez que todo el hielo se ha transformado en agua, se reanuda el aumento de temperatura, ahora con la capacidad calorífica del agua. Continúa el ascenso hasta que se llega a los 100°C, momento en que de nuevo se detiene el aumento, mientras el agua se transforma de manera turbulenta en vapor de agua, también a 100°C. Sólo cuando todo el agua se ha convertido en vapor de agua continúa el ascenso de temperatura, ahora con la capacidad calorífica del vapor de agua. | Una vez que todo el hielo se ha transformado en agua, se reanuda el aumento de temperatura, ahora con la capacidad calorífica del agua. Continúa el ascenso hasta que se llega a los 100°C, momento en que de nuevo se detiene el aumento, mientras el agua se transforma de manera turbulenta en vapor de agua, también a 100°C. Sólo cuando todo el agua se ha convertido en vapor de agua continúa el ascenso de temperatura, ahora con la capacidad calorífica del vapor de agua. | ||
| - | A la inversa ocurre si comenzamos con vapor y vamos extrayendo calor gradualmente. La temperatura va descendiendo, pero el descenso se interrumpe mientras el vapor | + | A la inversa ocurre si comenzamos con vapor y vamos extrayendo calor gradualmente. La temperatura va descendiendo, pero el descenso se interrumpe mientras el vapor se licúa y mientras el agua se congela. |
Concluimos entonces que un segundo efecto del calor es el cambio de fase. A la temperatura del punto de fusión o de ebullición, el sistema absorbe o cede una cantidad de calor que es proporcional a la masa de sustancia que cambia de fase | Concluimos entonces que un segundo efecto del calor es el cambio de fase. A la temperatura del punto de fusión o de ebullición, el sistema absorbe o cede una cantidad de calor que es proporcional a la masa de sustancia que cambia de fase | ||
| - | <center><math>Q = m\,\Delta h_f\qquad\qquad \mbox{o}\qquad\qquad Q = m\,\Delta | + | <center><math>Q = m\,\Delta h_f\qquad\qquad \mbox{o}\qquad\qquad Q = m\,\Delta h_b</math></center> |
| - | donde <math>\Delta h_f</math> es la ''entalpía de fusíón'' y <math>\Delta | + | donde <math>\Delta h_f</math> es la ''entalpía de fusíón'' y <math>\Delta h_b</math> la ''entalpía de vaporización'' (o ebullición). Estas entalpía también se llaman “calores latentes”, aunque este nombre se desaconseja. |
Hay que destacar que el valor de estas entalpías y la temperatura a la que se produce el cambio de fase son funciones de la presión. Cuando se dice “el agua se congela a 0°C” se entiende que es “a 101325 Pa de presión”, aunque no se diga. Lo mismo ocurre con la ebullición, que solo a esa presión se produce a 100°C (o siendo extremadamente precisos a 99.97°C). Si colocámos agua en un recipiente con un émbolo sobre el que situamos pesas de forma que la presión sea de 500 kPa, entonces la ebullición se produce a 151.8°C. También el valor de la entalpía de fusión y de ebullición es dependiente de la presión existente. | Hay que destacar que el valor de estas entalpías y la temperatura a la que se produce el cambio de fase son funciones de la presión. Cuando se dice “el agua se congela a 0°C” se entiende que es “a 101325 Pa de presión”, aunque no se diga. Lo mismo ocurre con la ebullición, que solo a esa presión se produce a 100°C (o siendo extremadamente precisos a 99.97°C). Si colocámos agua en un recipiente con un émbolo sobre el que situamos pesas de forma que la presión sea de 500 kPa, entonces la ebullición se produce a 151.8°C. También el valor de la entalpía de fusión y de ebullición es dependiente de la presión existente. | ||
| Línea 344: | Línea 848: | ||
Así, por ejemplo, para el caso del agua tenemos | Así, por ejemplo, para el caso del agua tenemos | ||
| - | <center><math>\Delta h_f = 334\,\frac{\mathrm{kJ}}{\mathrm{kg}}\qquad\qquad \Delta | + | <center><math>\Delta h_f = 334\,\frac{\mathrm{kJ}}{\mathrm{kg}}\qquad\qquad \Delta h_b = 2257\,\frac{\mathrm{kJ}}{\mathrm{kg}}</math></center> |
Si deseamos hallar el calor necesario para llevar una masa de 1 kg de hielo desde -10°C al estado de vapor de agua a 315°C a la presión atmosférica, habrá que considerar tres valores para los incrementos de temperatura y dos para los cambios de fase, resultando una tabla como la siguiente | Si deseamos hallar el calor necesario para llevar una masa de 1 kg de hielo desde -10°C al estado de vapor de agua a 315°C a la presión atmosférica, habrá que considerar tres valores para los incrementos de temperatura y dos para los cambios de fase, resultando una tabla como la siguiente | ||
| Línea 360: | Línea 864: | ||
| Fusión | | Fusión | ||
| 334 | | 334 | ||
| - | | 10.9 | + | | 10.9 |
|- | |- | ||
| Agua a 100°C | | Agua a 100°C | ||
| 418 | | 418 | ||
| - | | 13.7 | + | | 13.7 |
|- | |- | ||
| Ebullición | | Ebullición | ||
| 2257 | | 2257 | ||
| - | | 73.7 | + | | 73.7 |
|- | |- | ||
| Vapor a 115°C | | Vapor a 115°C | ||
| 31.4 | | 31.4 | ||
| - | | 1.0 | + | | 1.0 |
|- | |- | ||
! Total | ! Total | ||
| Línea 386: | Línea 890: | ||
[[Archivo:flujo-interno-calor.png|right]] | [[Archivo:flujo-interno-calor.png|right]] | ||
| - | Si consideramos un sistema formado por las dos partes en contacto (sistema conjunto que no estará en equilibrio, por no estar todo él a la misma temperatura), entonces si | + | Si consideramos un sistema formado por las dos partes en contacto (sistema conjunto que no estará en equilibrio, por no estar todo él a la misma temperatura), entonces si el sistema está aislado térmicamente del exterior (por paredes adiabáticas) |
<center><math>Q = 0\,</math></center> | <center><math>Q = 0\,</math></center> | ||
| Línea 396: | Línea 900: | ||
que nos dice que todo el calor que sale de uno de los subsistemas va a parar al otro, sin desaparecer por el camino | que nos dice que todo el calor que sale de uno de los subsistemas va a parar al otro, sin desaparecer por el camino | ||
| - | <center><math>Q_{1\mathrm{in}}=Q_{2\mathrm{out}}</math></center> | + | <center><math>Q_{1\mathrm{in}}=Q_{2\mathrm{out}}\,</math></center> |
El resultado es una temperatura intermedia entre las iniciales de ambas partes. La temperatura final puede coincidir con el punto de fusión o el de ebullición si en uno de los sistemas ocurre un cambio de fase parcial. Si no ocurre, la temperatura final es una media ponderada de las dos iniciales | El resultado es una temperatura intermedia entre las iniciales de ambas partes. La temperatura final puede coincidir con el punto de fusión o el de ebullición si en uno de los sistemas ocurre un cambio de fase parcial. Si no ocurre, la temperatura final es una media ponderada de las dos iniciales | ||
| Línea 402: | Línea 906: | ||
<center><math>C_1(T_f-T_1) +C_2(T_f-T_2) = 0\qquad\Rightarrow\qquad T_f = \frac{C_1 T_1+C_2T_2}{C_1+C_2}</math></center> | <center><math>C_1(T_f-T_1) +C_2(T_f-T_2) = 0\qquad\Rightarrow\qquad T_f = \frac{C_1 T_1+C_2T_2}{C_1+C_2}</math></center> | ||
| - | Si sí hay cambio de fase, es preciso analizar si el calor que sale de uno de los sistemas es suficiente para producir un cambio de fase de toda la sustancia o de solo una parte de ella. | + | Gráficamente, sería lo siguiente: Tenemos inicialmente dos subsistemas a temperaturas diferentes, el calor que entra en el 1 sale del 2. Esto se ve como una recta creciente, para la temperatura del medio 1 y una decreciente para la del medio 2. Inicialmente cada parte tiene una temperatura distinta. El equilibrio se alcanza cuando las rectas se cortan. El valor del calor en ese punto es el que sale de una parte y entra en la otra. |
| + | |||
| + | <center>[[Archivo:capacidad-calorifica-02.png]]</center> | ||
| + | |||
| + | Si sí hay cambio de fase, es preciso analizar si el calor que sale de uno de los sistemas es suficiente para producir un cambio de fase de toda la sustancia o de solo una parte de ella. | ||
| + | |||
| + | {{ejemplo|'''Mezcla de agua y hielo''' | ||
| + | |||
| + | Si ponemos en contacto 100 g de hielo a 0°C con 1 kg de agua a 20°C, del agua pueden salir 83.7 kJ, y solo se necesitan 33.4 kJ para fundir todo el hielo, con lo que se funde todo y se llega a una temperatura final de 11 °C. Si en cambio se pone 1 kg de hielo no hay calor suficiente para fundirlo todo y en el estado final tenemos 749 g de hielo y 1251 g de agua, ambos a 0°C. | ||
| + | |||
| + | <center>[[Archivo:Mezcla-agua-hielo-03.png|343px]]{{qquad}}{{qquad}}[[Archivo:Mezcla-agua-hielo-04.png|508px]]</center> | ||
| + | |||
| + | }} | ||
| + | |||
| + | En el caso particular de que se pongan en contacto dos cantidades de la misma sustancia (por ejemplo, que se vierta agua caliente en un baño de agua fría), la temperatura final se puede poner en función de las masas respectivas (suponiendo calores específicos independientes de la temperatura) | ||
| + | |||
| + | <center><math>C_1 = m_1c\qquad\qquad C_2 = m_2c\qquad\Rightarrow\qquad T_f = \frac{m_1T_1+m_2T_2}{m_1+m_2}</math></center> | ||
| + | |||
| + | ==Baños térmicos== | ||
| + | Si se ponen en contacto dos subsistemas de capacidades caloríficas <math>C_0</math> y <math>C_1</math>, y no hay trasferencias de calor adicionales, según hemos visto la temperatura final del sistema es | ||
| + | |||
| + | <center><math>T_f = \frac{C_0 T_0+C_1T_1}{C_0+C_1}</math></center> | ||
| + | |||
| + | Supongamos ahora que una de las dos capacidades es mucho mayor que la otra, <math>C_0\gg C_1</math>. Por ejemplo, si sumergimos un vaso de agua caliente en una piscina fría. En ese caso | ||
| + | |||
| + | <center><math>T_f \simeq \frac{C_0T_0}{C_0}=T_0</math></center> | ||
| + | |||
| + | es decir, la temperatura final es aproximadamente la del de capacidad mayor. En el ejemplo del vaso de agua en la piscina, la temperatura final es la de la piscina que no se ve prácticamente afectada por la del vaso, mientras que el agua del vaso cambia hasta igualarse a la de la piscina. | ||
| + | |||
| + | Idealmente, si la capacidad de un sistema <math>S_0</math> es <math>C_0\to\infty</math>, su temperatura <math>T_0</math> permanece constante sea cual sea la temperatura de otro sistema que ponemos en contacto con él. La temperatura del otro sistema, en cambio, cambia hasta igualarse a <math>T_0</math>. Se dice entonces que <math>S_0</math> es un baño térmico, foco o reservorio de calor. | ||
| + | |||
| + | Cuando se dice que el ambiente o entorno de un sistema se encuentra a una temperatura <math>T_0</math> se presupone que este ambiente es un baño térmico de capacidad infinita. Por ello, su temperatura no se ve modificada por lo que le pase al sistema. | ||
| + | |||
| + | El que la temperatura del baño térmico no cambie no quiere decir que no entre o salga calor en él. Al contrario, lo que ocurre es que en un baño térmico puede entrar o salir todo el calor que sea necesario sin que se vea afectado. Por ello se denomina también “reservorio de calor”. Así, por ejemplo, al poner un sistema de capacidad <math>C_1</math> en contacto con un baño de capacidad <math>C_0</math> la temperatura final es | ||
| + | |||
| + | <center><math>T_f = \frac{C_0T_0+C_1T_1}{C_0+C_1} \quad \stackrel{C_0\to\infty}{\longrightarrow}\quad T_0</math></center> | ||
| + | |||
| + | y el calor que entra en el sistema | ||
| + | |||
| + | <center><math>Q_1 = C_1(T_f-T_1) \quad \stackrel{C_0\to\infty}{\longrightarrow}\quad C_1(T_0-T_1)\,</math></center> | ||
| + | |||
| + | y en el baño | ||
| + | |||
| + | <center><math>Q_2 = C_0(T_f-T_0) = C_0\left(\frac{C_0T_0+C_1T_1}{C_0+C_1}-T_0\right)=-\frac{C_1C_0(T_0-T_1)}{C_0+C_1} \quad \stackrel{C_0\to\infty}{\longrightarrow}\quad -C_1(T_0-T_1)</math></center> | ||
| + | |||
| + | Vemos que efectivamente es el baño el que proporciona el calor, aunque no cambie su temperatura. | ||
| + | |||
| + | Gráficamente, sería similar al caso anterior. El baño térmico, que tiene una capacidad calorífica gigantesca, se describe por una recta horizontal, con lo que la temperatura de equilibrio es la misma que la del baño. | ||
| + | |||
| + | <center>[[Archivo:capacidad-calorifica-03.png]]</center> | ||
| + | |||
| + | Lo mismo ocurre si el calor que entra en el sistema se emplea en un cambio de fase o para producir trabajo. En todos los casos el calor sale de un baño o reservorio, que no se ve afectado (idealmente). | ||
==Paredes y procesos adiabáticos== | ==Paredes y procesos adiabáticos== | ||
| Línea 423: | Línea 978: | ||
Conviene tener clara la diferencia entre proceso isotermo y proceso adiabático: | Conviene tener clara la diferencia entre proceso isotermo y proceso adiabático: | ||
| - | * Un proceso '''isotermo''' es aquél en que ''la temperatura permanece constante''. | + | * Un proceso '''isotermo''' es aquél en que ''la temperatura permanece constante'', <math>\mathrm{d}T = 0</math> en todo momento. |
| - | * Un proceso '''adiabático''' es aquél en que ''no se intercambia calor entre el entorno y el sistema''. | + | * Un proceso '''adiabático''' es aquél en que ''no se intercambia calor entre el entorno y el sistema'', <math>\delta Q=0</math> en todo momento. |
Podría pensarse que, si no se intercambia calor, la temperatura necesariamente permanece constante, pero no es así. Un proceso de cambio de fase producido por calor que entre desde el exterior es isotermo, pero no adiabático. La expansión de un gas en un recipiente aislado térmicamente del exterior es adiabático, pero no isotermo (al expandirse el gas se enfría). | Podría pensarse que, si no se intercambia calor, la temperatura necesariamente permanece constante, pero no es así. Un proceso de cambio de fase producido por calor que entre desde el exterior es isotermo, pero no adiabático. La expansión de un gas en un recipiente aislado térmicamente del exterior es adiabático, pero no isotermo (al expandirse el gas se enfría). | ||
| - | == | + | ==Dependencia del camino== |
| - | + | El calor, como el trabajo, es una cantidad que depende del proceso y no solo de los estados inicial y final. | |
| + | |||
| + | A modo de ejemplo, consideremos el mismo ejemplo que se ve en el caso del [[Trabajo_en_termodinámica_(GIE)#Dependencia_del_camino|trabajo]]: un gas que ocupa inicialmente un volumen <math>V_A</math> a una presión <math>p_A</math> y temperatura <math>T_A</math>. Este gas se comprime cuasiestáticamente hasta que su volumen vale <math>V_B=V_A/2</math> a una presión <math>p_B = 2p_A</math>. ¿Cuanto calor entra en el gas? | ||
| + | |||
| + | Estas son algunas de las posibilidades: | ||
| + | |||
| + | <center>[[Archivo:proceso-dos-estados-01.png]]{{qquad}}{{qquad}}[[Archivo:proceso-dos-estados-02.png]]</center> | ||
| + | |||
| + | ;Proceso isóbaro seguido de proceso isócoro: Podemos comprimir el gas a presión constante, bajando su temperatura, hasta que su volumen es la mitad del inicial. A partir de ahí lo volvemos a calentar a volumen constante hasta que la presión se eleva al doble. Gráficamente corresponde a una recta horizontal seguida de un segmento vertical, siendo C el vértice intermedio. El calor que entra es suma de dos contribuciones: | ||
| + | |||
| + | <center><math>Q^{A\to B}= Q^{A\to C}+Q^{C\to B}= nc_p(T_C-T_A)+nc_v(T_B-T_C)\,</math></center> | ||
| + | |||
| + | :Para poner este resultado en términos de la presión y el volumen hacemos uso de la relación de las capacidades específicas molares con la constante universal de los gases ideales | ||
| + | |||
| + | <center><math>Q^{A\to B}=\frac{\gamma nR(T_C-T_A)}{\gamma-1}+\frac{nR(T_B-T_C)}{\gamma-1}=\frac{\gamma p_A(V_B-V_A)}{\gamma-1}+\frac{V_B(p_B-p_A)}{\gamma-1}</math></center> | ||
| + | |||
| + | :que para este estado final concreto da | ||
| - | + | <center><math>Q^{A\to B}=\frac{\gamma p_A(V_A/2-V_A)}{\gamma-1}+\frac{(V_A/2)(2p_A-p_A)}{\gamma-1}=-\frac{p_AV_A}{2}</math></center> | |
| - | + | ;Proceso isócoro seguido de proceso isóbaro: Alternativamente, podemos empezar calentando el gas hasta que su presión sea el doble de la inicial (estado D) y luego enfriarlo hasta que se volumen se reduzca a la mitad. Gráficamente es un segmento vertical seguido de uno horizontal, siendo D el estado intermedio. El calor es ahora | |
| - | + | <center><math>Q=nc_v(T_D-T_A)+nc_P(T_B-T_D)=\frac{nR(T_D-T_A)+\gamma n R(T_B-T_D)}{\gamma-1}=\frac{(p_B-p_A)V_A+\gamma p_B(V_B-V_A)}{\gamma-1}</math></center> | |
| - | + | :que para este estado final vale | |
| - | + | ||
| - | + | ||
| - | + | <center><math>Q=\frac{(2p_A-p_A)V_A+\gamma (2p_A)(V_A/2-V_A)}{\gamma-1}=-p_AV_A</math></center> | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
[[Categoría:Primer principio de la termodinámica (GIE)]] | [[Categoría:Primer principio de la termodinámica (GIE)]] | ||
última version al 13:52 13 mar 2021
Contenido |
1 Definición
Sección 2-3 de Çengel & Boles
Una posible definición de calor en termodinámica es la siguiente:
- “El calor es la transferencia de energía a través de la frontera de un sistema debida a una diferencia de temperaturas”
De esta definición, cabe destacar varios aspectos que se detallan en las secciones siguientes y en otros artículos:
- El calor, como el trabajo, es una transferencia de energía, un paso de energía de un sitio a otro, no algo que se tiene o se almacena. La frase “hace mucho calor” no es correcta en termodinámica.
- El calor, como el trabajo, habla de lo que pasa en la frontera del sistema, no en su interior. Se debe a la interacción del sistema con su entorno.
- El calor, a diferencia del trabajo, está asociado a la diferencia de temperatura, que es una medida de la agitación de los átomos y moléculas. Por tanto, se debe a la transferencia de energía a través de fenómenos microscópicos (el trabajo se refiere a los macroscópicos).
2 Concepto de calor
A diferencia del trabajo, el calor carece de analogía en mecánica. Se trata de un concepto nuevo.
La experiencia nos dice que si colocamos un sistema en un cierto ambiente, el sistema evoluciona. Si colocamos un bloque de hielo al sol, sabemos que se funde. Si ponemos un termómetro de mercurio en la axila de una persona febril, el mercurio se dilata, y si es uno digital, se produce una corriente eléctrica en su interior.
Todos estos cambios se producen sin que haya trabajo asociado, simplemente por contacto. Deducimos entonces que “algo” ha pasado del entorno al sistema y a ese algo lo denominamos “calor”.
Los efectos del calor son varios:
- Cambio en la temperatura del sistema
- Cambio de fase del sistema
- Realización de trabajo
la realización de trabajo como consecuencia de la transferencia de calor se explica al estudiar el primer principio de la termodinámica y el funcionamiento de las máquinas térmicas. En este artículo describiremos los dos primeros efectos.
3 Unidades y signos
El calor es una transferencia de energía y se mide en las mismas unidades que ésta. En el SI, la unidad del calor es el julio (J).
Por razones históricas, se usa también la caloría (cal), definida hoy día como
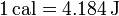
Sin embargo, debido a la existencia de diferentes definiciones de caloría, es preferible no usarla en absoluto. También se usa en medicina, biología y dietética la “caloría grande” (Cal), que en realidad es una kilocaloría ( = 4184 J).
En máquinas térmicas y refrigeradores se usa una unidad británica, la BTU, equivalente a 1055.056 J.
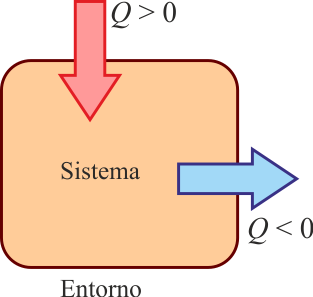
Como criterio para asignar signos al calor se sigue el principio de que:
- Si el calor entra en el sistema se considera positivo.
- Si el calor sale del sistema, es negativo.
Alternativamente, si presuponemos un sentido en el que está fluyendo el calor (calor que entra desde un foco a alta temperatura, o es desechado al ambiente frío), podemos definir
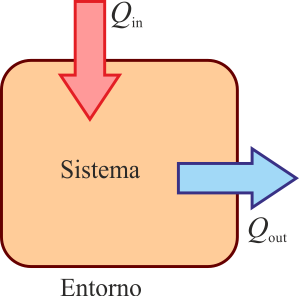
- Qin para el calor que entra en el sistema
- Qout para el calor que sale del sistema
siendo el calor neto intercambiado
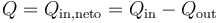
Tanto Qin como Qout pueden resultar negativos. Ello significa que el calor va en el sentido contrario al que habíamos supuesto.
4 Flujo de calor
En muchas ocasiones, no se está tan interesado en cuánto vale el calor total absorbido, sino cuánto calor entra en el sistema en la unidad de tiempo. Por ello se define el flujo de calor como
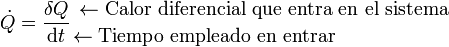
(¡Ojo al punto sobre la Q!). Se mide en el SI, como la potencia, en vatios (W).
El criterio de signos para el flujo de calor es el mismo que para el calor. Si está entrando calor en el sistema el flujo es positivo; si sale de él, es negativo.
Del mismo modo, podemos definir un flujo de calor hacia dentro o hacia afuera del sistema
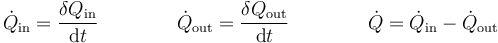
5 Calor por unidad de masa
El calor que entra en un sistema es una propiedad extensiva. En el caso de una sustancia pura o una mezcla de gases, el efecto del calor depende de la cantidad de materia que haya. Si lo que interesa es la cantidad de calor que entra o sale relativa a la masa, conviene usar el calor por unidad de masa
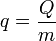
El calor por unidad de masa se mide en el SI en J/kg.
6 Efecto del calor en un sistema
De entre los efectos del calor sobre un sistema, hay tres especialmente destacados:
- El cambio de temperatura en el sistema.
- El cambio de fase de las sustancias
- La realización de trabajo, mecánico o de otro tipo.
Hay que destacar que el primer efecto, el cambio de temperatura, no siempre ocurre. Es perfectamente posible que en un sistema entre calor y la temperatura del sistema no cambie o incluso baje. Dependerá de si simultáneamente existe realización de trabajo o un posible cambio de fase.
7 Calor e incremento de temperatura
(Sección 4-3 de Çengel & Boles, "Calores específicos")
El primer efecto observable de la transferencia de calor a un sistema es el incremento de su temperatura. Hay que destacar que no siempre que entra calor en un sistema se produce un aumento de temperatura, depende de si también hay cambios de fase o se está realizando trabajo.
Suponiendo que la temperatura sí varía, si la cantidad de calor transferida es pequeña, la variación de temperatura es proporcional a ella, lo que se expresa matemáticamente
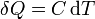
siendo C una propiedad del sistema denominada capacidad calorífica. De la definición se tiene que la capacidad calorífica se mide en el SI en J/K.
El calor diferencial es una diferencial inexacta (por eso expresa con el símbolo “δ”), lo que quiere decir que depende del proceso. Una misma cantidad de calor transferida a un sistema puede producir diferentes incrementos de temperatura, dependiendo de cómo se realice.
Dos casos particulares son importantes. Cuando se transfiere de manera cuasiestática calor a un sistema gaseoso
- si ocurre en un recipiente rígido, tenemos que el volumen es constante y
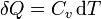
- siendo Cv la capacidad calorífica a volumen constante.
- Si el calor se comunica en un sistema abierto a la atmósfera, o con paredes que pueden moverse libremente, entonces la presión del sistema permanece constante (en un proceso cuasiestático, el sistema estará siempre en un estado de equilibrio mecánico con el exterior) y
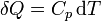
- siendo Cp la capacidad calorífica a presión constante.
Cuando se estudia el efecto del calor en el calentamiento de un sólido o un líquido se presupone que ocurre en un sistema abierto y que por tanto, aunque no se indique, se trata de una capacidad calorífica a presión constante.
Las capacidades caloríficas dependen de la temperatura, ya que no cuesta lo mismo elevar la temperatura de agua de 10°C a 11°C (4.193 kJ/kg) que lo que cuesta pasar de 95°C a 96°C (4.213 kJ/kg). Por ello, si queremos realizar un aumento grande de temperatura, es necesario sumar los calores diferenciales.
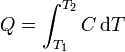
Si, como ocurre a menudo, la capacidad calorífica es aproximadamente constante en un rango de temperaturas, puede extraerse de la integral y escribirse
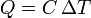
Cuando la capacidad calorífica es constante, podemos representar gráficamente la relación entre calor absorbido y aumento de temperatura mediante una línea recta. Despejando tenemos
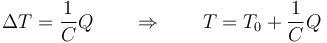

El que la capacidad vaya en el denominador quiere decir que cuanto mayor es la capacidad calorífica, menor es la variación de temperatura para un valor dado del calor.
Cuando la capacidad calorífica no es constante, en lugar de una recta tendremos una curva.
7.1 Capacidad calorífica y calor específico
La capacidad calorífica es una propiedad del sistema en su conjunto y depende de las propiedades de todas las partes del sistema. Además, como se ha indicado, no tiene el mismo valor para un proceso a presión constante que para uno a volumen constante.
La unidad de la capacidad calorífica es la de una energía dividida por una temperatura, en el SI se mide en J/K (aunque aun existen tablas donde aparece en cal/°C).
En el caso de una sustancia pura (agua, o un gas ideal, o incluso una mezcla de gases como el aire), la capacidad calorífica es una propiedad extensiva, proporcional a la cantidad de sustancia.
A partir de ella se define una propiedad específica: la capacidad calorífica por unidad de masa, más conocida como calor específico

En términos del calor específico, la cantidad de calor necesaria para producir un aumento diferencial de temperatura y uno finito

El calor específico tiene unidades en el SI de J/(kg·K). Su valor, como el de C es dependiente de la temperatura, y tiene un valor diferente según sea un proceso a volumen constante (cv) o a presión constante (cp). Para sólidos y líquidos se suele tabular su valor a presión constante a la presión atmosférica y a una temperatura dada.
Así, su valor para algunas sustancias habituales es
| Sustancia | cp (kJ/kg·K) | Sustancia | cp (kJ/kg·K) | Sustancia | cp (kJ/kg·K) |
|---|---|---|---|---|---|
| Aire seco | 1.012 | Agua (20°C) | 4.18 | Cemento ligero | 0.96 |
| Cobre | 0.385 | Etanol (40°C) | 0.65 | Hielo (0°C) | 2.09 |
| Hierro (20°C) | 0.46 | Madera | 2-3 | Vapor de agua (100°C) | 2.08 |
En la red pueden encontrase más valores para sólidos, líquidos y gases.
7.1.1 Calor específico del agua
En el caso del agua su valor comienza por 4.204 kJ/(kg·K) a 0°C, baja hasta 4.178 a 35°C y vuelve a aumentar hasta 4.219 a 100°C. A temperatura ambiente, un valor de 4.18, con solo dos cifras decimales, suele ser más que suficiente.
Un valor más preciso puede sacarse interpolando los valores y resulta la tabla
| tC (0°C) | cp (kJ/kg·mol) | tC (0°C) | cp (kJ/kg·mol) | tC (0°C) | cp (kJ/kg·mol) | tC (0°C) | cp (kJ/kg·mol) |
|---|---|---|---|---|---|---|---|
| 0 | 4.224 | 25 | 4.184 | 50 | 4.179 | 75 | 4.192 |
| 1 | 4.221 | 26 | 4.183 | 51 | 4.179 | 76 | 4.193 |
| 2 | 4.219 | 27 | 4.183 | 52 | 4.179 | 77 | 4.194 |
| 3 | 4.216 | 28 | 4.182 | 53 | 4.179 | 78 | 4.195 |
| 4 | 4.214 | 29 | 4.181 | 54 | 4.180 | 79 | 4.195 |
| 5 | 4.212 | 30 | 4.181 | 55 | 4.180 | 80 | 4.196 |
| 6 | 4.210 | 31 | 4.180 | 56 | 4.180 | 81 | 4.197 |
| 7 | 4.208 | 32 | 4.180 | 57 | 4.181 | 82 | 4.198 |
| 8 | 4.206 | 33 | 4.179 | 58 | 4.181 | 83 | 4.199 |
| 9 | 4.204 | 34 | 4.179 | 59 | 4.182 | 84 | 4.200 |
| 10 | 4.202 | 35 | 4.179 | 60 | 4.182 | 85 | 4.201 |
| 11 | 4.201 | 36 | 4.178 | 61 | 4.183 | 86 | 4.202 |
| 12 | 4.199 | 37 | 4.178 | 62 | 4.183 | 87 | 4.203 |
| 13 | 4.197 | 38 | 4.178 | 63 | 4.184 | 88 | 4.204 |
| 14 | 4.196 | 39 | 4.178 | 64 | 4.184 | 89 | 4.205 |
| 15 | 4.194 | 40 | 4.178 | 65 | 4.185 | 90 | 4.206 |
| 16 | 4.193 | 41 | 4.178 | 66 | 4.186 | 91 | 4.208 |
| 17 | 4.192 | 42 | 4.178 | 67 | 4.186 | 92 | 4.209 |
| 18 | 4.191 | 43 | 4.178 | 68 | 4.187 | 93 | 4.210 |
| 19 | 4.190 | 44 | 4.178 | 69 | 4.188 | 94 | 4.211 |
| 20 | 4.188 | 45 | 4.178 | 70 | 4.188 | 95 | 4.212 |
| 21 | 4.187 | 46 | 4.178 | 71 | 4.189 | 96 | 4.213 |
| 22 | 4.186 | 47 | 4.178 | 72 | 4.190 | 97 | 4.215 |
| 23 | 4.186 | 48 | 4.178 | 73 | 4.190 | 98 | 4.216 |
| 24 | 4.185 | 49 | 4.178 | 74 | 4.191 | 99 | 4.217 |
(Fuente NIST y elaboración propia)

Así para calentar 1kg de agua desde 0°C a 100°C, usando el valor promedio anterior se necesitan
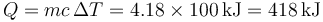
Un valor más exacto, usando la tabla de la referencia anterior y considerando incrementos de 5°C en 5°C nos da un calor ligeramente superior. El error, aunque apreciable, es de solo el 1%. Este error se reduce aun más si consideramos incrementos menores de temperatura.
7.2 Capacidad calorífica molar
(Çengel & Boles: sección 4-4)
En el caso de un gas, en lugar de la capacidad específica por unidad de masa se suele usar la capacidad calorífica molar, denotada también con c minúscula
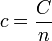
La capacidad calorífica molar se mide en J/(K·mol). Por ello, son sus unidades (y las expresiones en que aparece) las que permiten distinguirla del calor específico.
Como la capacidad calorífica y el calor específico, la capacidad calorífica molar se mide en dos variedades: a volumen constante (cv) y a presión constante (cp). Así, en procesos cuasiestáticos el calor necesario para producir un aumento diferencial de temperatura es

Las unidades de cp y cv son las mismas que las de R la constante de los gases ideales. Por ello, interesa saber no sólo cuanto valen en sentido absoluto, sino también relativamente a R. Cuando se hace esto para una serie de gases habituales se obtiene la siguiente tabla
| Gas | cv J/(K·mol) | cp J/(K·mol) | cv / R | cp / R | γ = cp / cv |
|---|---|---|---|---|---|
| He | 12.5 | 20.8 | 1.50 | 2.50 | 1.67 |
| Ne | 12.5 | 20.8 | 1.50 | 2.50 | 1.67 |
| Ar | 12.5 | 20.8 | 1.50 | 2.50 | 1.67 |
| H2 | 20.18 | 28.82 | 2.42 | 3.47 | 1.43 |
| N2 | 20.8 | 29.12 | 2.50 | 3.50 | 1.40 |
| O2 | 21.1 | 29.38 | 2.54 | 3.54 | 1.39 |
| CO2 | 28.46 | 36.94 | 3.42 | 4.44 | 1.30 |
| Metano (CH4) | 27.3 | 35.7 | 3.28 | 4.29 | 1.31 |
| Vapor de agua | 28.03 | 37.47 | 3.37 | 4.50 | 1.34 |
De esta tabla podemos obtener algunas conclusiones:
- Para casi todos estos gases se cumple
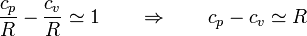
- esta propiedad se conoce como ley de Mayer.
- Para los gases nobles (monoatómicos) se verifica casi exactamente
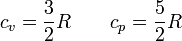
- Para los gases diatómicos (N2, H2, O2) se cumple, pero con menor aproximación
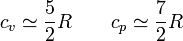
- Para los gases de más átomos (agua o CO2, por ejemplo) no existe una fórmula sencilla para los valores de cp y cv.
En el caso del aire seco, al tratarse de una mezcla de gases y no de una sustancia pura, hay que tener cuidado al definir el concepto molar. Puede medirse experimentalmente el valor de los calores específicos (por unidad de masa) y luego considerar el gas como una sustancia con peso molecular el medio de sus componentes
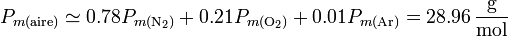
Con esta precisión queda
| Gas | cv J/(K·mol) | cp J/(K·mol) | cv / R | cp / R | γ = cp / cv |
|---|---|---|---|---|---|
| Aire | 20.8 | 29.2 | 2.501 | 3.52 | 1.41 |
Vemos que, a estos efectos, el aire puede ser considerado como un gas diatómico.
La última columna de la tabla es la proporción entre capacidades caloríficas
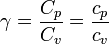
Teniendo en cuenta que aproximadamente
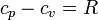
las dos capacidades caloríficas molares pueden escribirse en la forma

Según estos datos, si tenemos inicialmente 0.1 m³ de aire a 300K y 100 kPa y queremos calentarlo hasta 600K manteniendo constante su volumen debemos introducir un calor
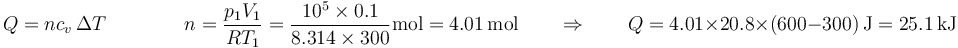
mientras que si lo que mantenemos constante es la presión
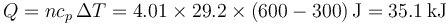
En general se necesita más calor para realizar un calentamiento a presión constante que uno a volumen constante.
7.2.1 Calor en función de la presión y el volumen
Para el caso de un gas ideal, pueden obtenerse expresiones alternativas para el calor que no requiere el cálculo de la temperatura ni el uso del número de moles.
- A volumen constante
- Aplicamos la proporcionalidad entre cv y R
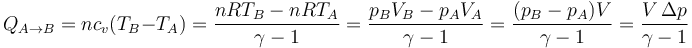
- A presión constante
- Aplicamos la proporcionalidad entre cp y R
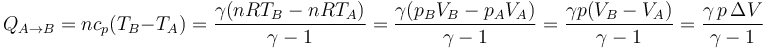
8 Calor y cambios de fase
Cuando se tiene un bloque de hielo a una temperatura de, por ejemplo, -10°C y se le comunica gradualmente calor, se aprecia que su temperatura va aumentando. Sin embargo, al llegar a la temperatura de 0°C, se detiene el incremento de temperatura. Durante un rato, aunque se añade calor, la temperatura del sistema permanece constante. En su lugar, lo que está ocurriendo es que el hielo a 0°C se va fundiendo transformándose en agua líquida, también a 0°C.
Una vez que todo el hielo se ha transformado en agua, se reanuda el aumento de temperatura, ahora con la capacidad calorífica del agua. Continúa el ascenso hasta que se llega a los 100°C, momento en que de nuevo se detiene el aumento, mientras el agua se transforma de manera turbulenta en vapor de agua, también a 100°C. Sólo cuando todo el agua se ha convertido en vapor de agua continúa el ascenso de temperatura, ahora con la capacidad calorífica del vapor de agua.
A la inversa ocurre si comenzamos con vapor y vamos extrayendo calor gradualmente. La temperatura va descendiendo, pero el descenso se interrumpe mientras el vapor se licúa y mientras el agua se congela.
Concluimos entonces que un segundo efecto del calor es el cambio de fase. A la temperatura del punto de fusión o de ebullición, el sistema absorbe o cede una cantidad de calor que es proporcional a la masa de sustancia que cambia de fase
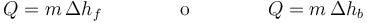
donde Δhf es la entalpía de fusíón y Δhb la entalpía de vaporización (o ebullición). Estas entalpía también se llaman “calores latentes”, aunque este nombre se desaconseja.
Hay que destacar que el valor de estas entalpías y la temperatura a la que se produce el cambio de fase son funciones de la presión. Cuando se dice “el agua se congela a 0°C” se entiende que es “a 101325 Pa de presión”, aunque no se diga. Lo mismo ocurre con la ebullición, que solo a esa presión se produce a 100°C (o siendo extremadamente precisos a 99.97°C). Si colocámos agua en un recipiente con un émbolo sobre el que situamos pesas de forma que la presión sea de 500 kPa, entonces la ebullición se produce a 151.8°C. También el valor de la entalpía de fusión y de ebullición es dependiente de la presión existente.
Asimismo, para los valores que aparecen en las tablas, se presupone que la ebullición se produce a presión constante, no a volumen constante, es decir, que al transformarse el líquido en vapor, éste se expande.
Así, por ejemplo, para el caso del agua tenemos

Si deseamos hallar el calor necesario para llevar una masa de 1 kg de hielo desde -10°C al estado de vapor de agua a 315°C a la presión atmosférica, habrá que considerar tres valores para los incrementos de temperatura y dos para los cambios de fase, resultando una tabla como la siguiente
| Paso | Q (kJ) | Fracción del calor total (%) |
|---|---|---|
| Hielo a 0°C | 21.2 | 0.7 |
| Fusión | 334 | 10.9 |
| Agua a 100°C | 418 | 13.7 |
| Ebullición | 2257 | 73.7 |
| Vapor a 115°C | 31.4 | 1.0 |
| Total | 3061.4 | 100 |
Vemos que la mayor parte del calor es necesario para pasar de la fase líquida a la gaseosa. En este cambio de fase es necesario romper los enlaces entre las moléculas de agua, lo cual requiere mucha más energía que un simple aumento de la agitación térmica.
9 Calor y equilibrio térmico
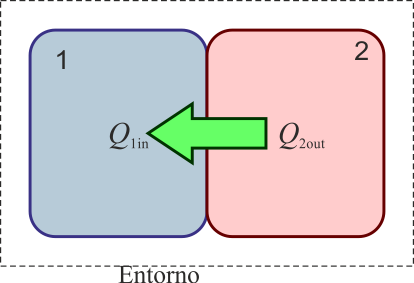
Cuando se ponen en contacto dos sistemas (“1” y “2”) a diferente temperatura (por ejemplo, T2 > T1) se produce, de acuerdo con el segundo principio de la termodinámica, un flujo de calor desde el de más temperatura al de menos hasta que ambas temperaturas se igualan.
Si consideramos un sistema formado por las dos partes en contacto (sistema conjunto que no estará en equilibrio, por no estar todo él a la misma temperatura), entonces si el sistema está aislado térmicamente del exterior (por paredes adiabáticas)
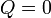
Por ser una propiedad extensiva el calor total es la suma de lo que va a cada parte
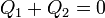
que nos dice que todo el calor que sale de uno de los subsistemas va a parar al otro, sin desaparecer por el camino
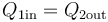
El resultado es una temperatura intermedia entre las iniciales de ambas partes. La temperatura final puede coincidir con el punto de fusión o el de ebullición si en uno de los sistemas ocurre un cambio de fase parcial. Si no ocurre, la temperatura final es una media ponderada de las dos iniciales
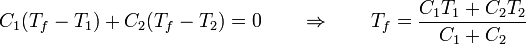
Gráficamente, sería lo siguiente: Tenemos inicialmente dos subsistemas a temperaturas diferentes, el calor que entra en el 1 sale del 2. Esto se ve como una recta creciente, para la temperatura del medio 1 y una decreciente para la del medio 2. Inicialmente cada parte tiene una temperatura distinta. El equilibrio se alcanza cuando las rectas se cortan. El valor del calor en ese punto es el que sale de una parte y entra en la otra.
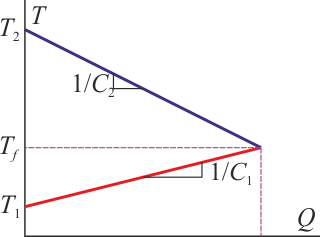
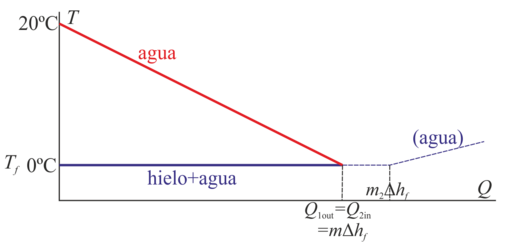
Si sí hay cambio de fase, es preciso analizar si el calor que sale de uno de los sistemas es suficiente para producir un cambio de fase de toda la sustancia o de solo una parte de ella.
Si ponemos en contacto 100 g de hielo a 0°C con 1 kg de agua a 20°C, del agua pueden salir 83.7 kJ, y solo se necesitan 33.4 kJ para fundir todo el hielo, con lo que se funde todo y se llega a una temperatura final de 11 °C. Si en cambio se pone 1 kg de hielo no hay calor suficiente para fundirlo todo y en el estado final tenemos 749 g de hielo y 1251 g de agua, ambos a 0°C.

En el caso particular de que se pongan en contacto dos cantidades de la misma sustancia (por ejemplo, que se vierta agua caliente en un baño de agua fría), la temperatura final se puede poner en función de las masas respectivas (suponiendo calores específicos independientes de la temperatura)
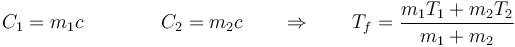
10 Baños térmicos
Si se ponen en contacto dos subsistemas de capacidades caloríficas C0 y C1, y no hay trasferencias de calor adicionales, según hemos visto la temperatura final del sistema es
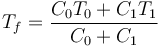
Supongamos ahora que una de las dos capacidades es mucho mayor que la otra, 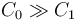 . Por ejemplo, si sumergimos un vaso de agua caliente en una piscina fría. En ese caso
. Por ejemplo, si sumergimos un vaso de agua caliente en una piscina fría. En ese caso

es decir, la temperatura final es aproximadamente la del de capacidad mayor. En el ejemplo del vaso de agua en la piscina, la temperatura final es la de la piscina que no se ve prácticamente afectada por la del vaso, mientras que el agua del vaso cambia hasta igualarse a la de la piscina.
Idealmente, si la capacidad de un sistema S0 es 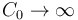 , su temperatura T0 permanece constante sea cual sea la temperatura de otro sistema que ponemos en contacto con él. La temperatura del otro sistema, en cambio, cambia hasta igualarse a T0. Se dice entonces que S0 es un baño térmico, foco o reservorio de calor.
, su temperatura T0 permanece constante sea cual sea la temperatura de otro sistema que ponemos en contacto con él. La temperatura del otro sistema, en cambio, cambia hasta igualarse a T0. Se dice entonces que S0 es un baño térmico, foco o reservorio de calor.
Cuando se dice que el ambiente o entorno de un sistema se encuentra a una temperatura T0 se presupone que este ambiente es un baño térmico de capacidad infinita. Por ello, su temperatura no se ve modificada por lo que le pase al sistema.
El que la temperatura del baño térmico no cambie no quiere decir que no entre o salga calor en él. Al contrario, lo que ocurre es que en un baño térmico puede entrar o salir todo el calor que sea necesario sin que se vea afectado. Por ello se denomina también “reservorio de calor”. Así, por ejemplo, al poner un sistema de capacidad C1 en contacto con un baño de capacidad C0 la temperatura final es
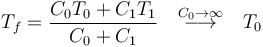
y el calor que entra en el sistema
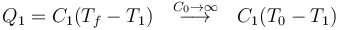
y en el baño
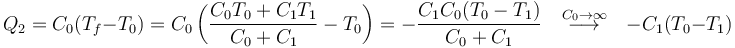
Vemos que efectivamente es el baño el que proporciona el calor, aunque no cambie su temperatura.
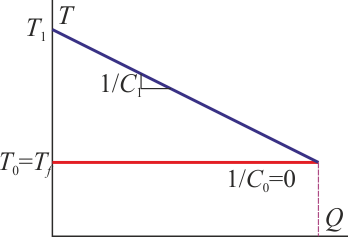
Gráficamente, sería similar al caso anterior. El baño térmico, que tiene una capacidad calorífica gigantesca, se describe por una recta horizontal, con lo que la temperatura de equilibrio es la misma que la del baño.
Lo mismo ocurre si el calor que entra en el sistema se emplea en un cambio de fase o para producir trabajo. En todos los casos el calor sale de un baño o reservorio, que no se ve afectado (idealmente).
11 Paredes y procesos adiabáticos
Cuando un sistema no experimenta cambios pese a ponerse en contacto con otros a diferente temperatura, porque sus paredes lo impiden, se dice que está aislado térmicamente y que las paredes son adiabáticas. A través de una frontera adiabática
No existen las paredes perfectamente adiabáticas, como veremos al considerar la transmisión de calor, pero se pueden conseguir buenas aproximaciones. Una muy común es el vaso Dewar, que constituye la base de los termos de café. Se trata de dos frascos, uno contenido dentro de los cuales existe aire (si es posible a baja presión, haciendo el vacío parcialmente). Es el mismo esquema de las ventanas y paredes con cámara de aire. Para reducir aun más el posible flujo de calor, las superficies interiores pueden estar metalizadas.
Es costumbre, por el principio de los vasos Dewar, indicar las paredes adiabáticas en las ilustraciones mediante una línea doble, frente a las paredes diatermas, que se representan por una línea sencilla. Así, en las ilustraciones de la figura, el caso de arriba representaría dos cámaras de gas que no están aisladas entre sí ni con el exterior; en el caso intermedio está aisladas del exterior, pero no entre sí; en el caso inferior el aislamiento térmico de cada gas es total.
En un sistema aislado del exterior por paredes adiabáticas no puede haber calor entrando o saliendo del sistema y por tanto todos los procesos que ocurren en él se denomina adiabáticos.
Más en general un sistema experimenta un proceso adiabático cuando no intercambia calor con el ambiente, independientemente de si las paredes son aislantes o no. Así por ejemplo, en una compresión abrupta de un gas, éste no tiene tiempo para intercambiar calor con el entorno y la compresión se puede suponer adiabática. La compresión en los cilindros de un motor de explosión son un ejemplo típico, pero también lo son las ondas de sonido.
Los procesos adiabáticos pueden, como cualquier otro proceso, ser cuasiestáticos o no serlo.
Conviene tener clara la diferencia entre proceso isotermo y proceso adiabático:
- Un proceso isotermo es aquél en que la temperatura permanece constante, dT = 0 en todo momento.
- Un proceso adiabático es aquél en que no se intercambia calor entre el entorno y el sistema, δQ = 0 en todo momento.
Podría pensarse que, si no se intercambia calor, la temperatura necesariamente permanece constante, pero no es así. Un proceso de cambio de fase producido por calor que entre desde el exterior es isotermo, pero no adiabático. La expansión de un gas en un recipiente aislado térmicamente del exterior es adiabático, pero no isotermo (al expandirse el gas se enfría).
12 Dependencia del camino
El calor, como el trabajo, es una cantidad que depende del proceso y no solo de los estados inicial y final.
A modo de ejemplo, consideremos el mismo ejemplo que se ve en el caso del trabajo: un gas que ocupa inicialmente un volumen VA a una presión pA y temperatura TA. Este gas se comprime cuasiestáticamente hasta que su volumen vale VB = VA / 2 a una presión pB = 2pA. ¿Cuanto calor entra en el gas?
Estas son algunas de las posibilidades:
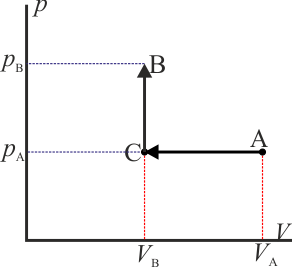
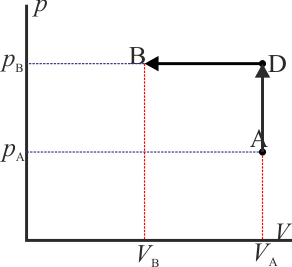
- Proceso isóbaro seguido de proceso isócoro
- Podemos comprimir el gas a presión constante, bajando su temperatura, hasta que su volumen es la mitad del inicial. A partir de ahí lo volvemos a calentar a volumen constante hasta que la presión se eleva al doble. Gráficamente corresponde a una recta horizontal seguida de un segmento vertical, siendo C el vértice intermedio. El calor que entra es suma de dos contribuciones:
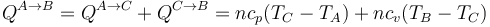
- Para poner este resultado en términos de la presión y el volumen hacemos uso de la relación de las capacidades específicas molares con la constante universal de los gases ideales
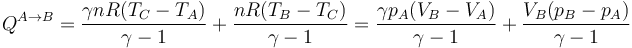
- que para este estado final concreto da
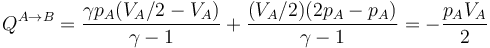
- Proceso isócoro seguido de proceso isóbaro
- Alternativamente, podemos empezar calentando el gas hasta que su presión sea el doble de la inicial (estado D) y luego enfriarlo hasta que se volumen se reduzca a la mitad. Gráficamente es un segmento vertical seguido de uno horizontal, siendo D el estado intermedio. El calor es ahora
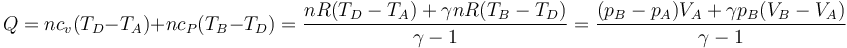
- que para este estado final vale