Problemas de Gas Ideal
De Laplace
(→Ecuación de Van der Waals) |
(→Ecuación de Van der Waals) |
||
| Línea 57: | Línea 57: | ||
== Ecuación de Van der Waals == | == Ecuación de Van der Waals == | ||
| - | [[Categoría:Problemas de gas ideal]] | + | [[Categoría:Problemas de gas ideal]][[Categoría:Gas ideal]] |
Revisión de 10:03 23 abr 2009
1 Ecuación de estado
Utilizando la ecuación de estado de los gases ideales, responda a las siguientes preguntas
- ¿Que volumen ocupa un mol de gas en condiciones estándar?
- ¿Cuantas moléculas hay en
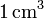 de gas ideal a una temperatura de 300 K y a una presión de 1 atm?
de gas ideal a una temperatura de 300 K y a una presión de 1 atm?
¿Y si la presión es de 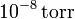 ?
?
2 Pistón oscilante
Un cilindro de 2.4 m de altura se llena con 0.1 moles de un gas ideal a una temperatura y presión normales. El cilindro se cierra entonces con un pistón de masa 1.4 kg que se deja caer hasta alcanzar el equilibrio.
- Determine la altura h0 del pistón suponiendo que la temperatura del gas no varía en la compresión.
- Suponga que el pistón se empuja ligeramente hacia abajo más allá de la posición de equilibrio y luego se libera. Suponiendo que la temperatura del gas permanece constante y que el rozamiento del pistón es despreciable, demuestre que el pistón describe un movimiento armónico simple y determine su frecuencia.
3 Trabajo en distintos procesos
Un mol de un gas ideal está contenido en un cilindro que tiene un émbolo móvil. La presión, volumen y temperatura iniciales son Pi,Vi,Ti, respectivamente. Calcule el trabajo realizado sobre el gas para los siguientes procesos, y dibuje cada uno de ellos en un diagrama PV
- Una compresión isobárica en la que el volumen final sea la mitad del volumen inicial
- Una compresión isotérmica en la que la presión final se cuatro veces la inicial
- Un proceso isócoro en el que la presión final sea el triple de la inicial.
4 Trabajo en un ciclo
Las condiciones iniciales del estado de un gas perfecto son: V=4 l, P=2 atm, t = 27o C. Se dilata el gas a presión constante hasta duplicar su volumen. A continuación se comprime isotérmicamente hasta recuperar el volumen inicial. Finalmente se enfría a volumen constante hasta su presión inicial.
- Dibuje el ciclo en un diagrama PV.
- Calcule el trabajo realizado sobre el gas en el ciclo suponiendo que los procesos son cuasiestáticos.





