Trabajo en distintos procesos
De Laplace
Contenido |
1 Enunciado
Un mol de un gas ideal está contenido en un cilindro que tiene un émbolo móvil. La presión, volumen y temperatura iniciales son Pi,Vi,Ti, respectivamente. Calcula el trabajo realizado sobre el gas para los siguientes procesos, y dibuja cada uno de ellos en un diagrama PV
- Una compresión isobárica en la que el volumen final sea la mitad del volumen inicial
- Una compresión isotérmica en la que la presión final se cuatro veces la inicial
- Un proceso isócoro en el que la presión final sea el triple de la inicial.
2 Introducción
En general, el trabajo realizado sobre un sistema hidrostático en un proceso cuasiestático entre los estados 1 y 2 es
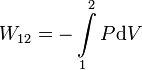
Para poder calcular esta integral hay que saber como varía la presión en función del volumen. Examinemos cada uno de los procesos propuestos en el enunciado
3 Proceso isobárico
En este caso la presión se mantiene constante e igual a la inicial. Los estados inicial y final son
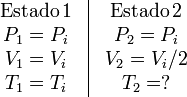
Como el proceso es a presión constante, ésta puede sacarse de la integral. Tenemos entonces
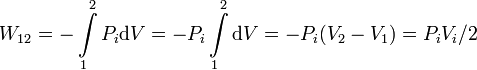
El trabajo es positivo, es decir, contribuye a aumentar la energía interna del gas. Esto es siempre así en una compresión.
4 Proceso isotermo
En este caso la presión varía al realizar el proceso, pero la ecuación de estado del gas ideal nos da la relación entre presión y volumen. Tenemos
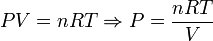
Los estados inicial y final son
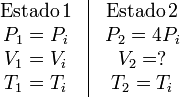
EL trabajo es
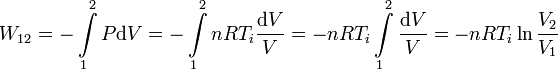
Hemos usado que la temperatura es constante y por tanto puede salir de la integral. No tenemos el volumen inicial, pero podemos expresar el trabajo en función de las presiones usando la ley de Boyle. Como el proceso es isotermo se cumple
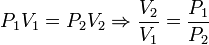
y el trabajo se puede expresar como
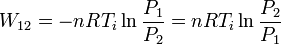
Para comparar con el resultado anterior usamos la ecuación de estado para expresar la temperatura en función de la presión y volumen iniciales
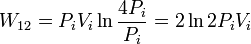
De nuevo el trabajo es positivo y puede observarse que es mayor que el obtenido en el proceso isobárico.
5 Proceso isócoro
En este caso, al no haber cambio de volumen, no hay trabajo realizado sobre el gas. Tenemos entonces
W12 = 0





