Caso de ciclo Ericsson
De Laplace
(→B→C) |
|||
| (Una edición intermedia no se muestra.) | |||
| Línea 162: | Línea 162: | ||
En el segundo paso se realiza trabajo a [[Trabajo_en_termodinámica_(GIE)#Proceso_is.C3.B3baro|presión constante]] siendo su expresión | En el segundo paso se realiza trabajo a [[Trabajo_en_termodinámica_(GIE)#Proceso_is.C3.B3baro|presión constante]] siendo su expresión | ||
| - | <center><math>W^{B\to C}=-p_C(V_C-V_B)</math></center> | + | <center><math>W^{B\to C}=-p_C(V_C-V_B)\,</math></center> |
y su valor | y su valor | ||
| Línea 226: | Línea 226: | ||
===D→A=== | ===D→A=== | ||
| - | En el | + | En el último paso se realiza trabajo a presión constante de nuevo |
| - | <center><math>W^{D\to A}=-p_A(V_A-V_D)</math></center> | + | <center><math>W^{D\to A}=-p_A(V_A-V_D)\,</math></center> |
y su valor | y su valor | ||
última version al 21:45 14 mar 2013
Contenido |
1 Enunciado
Se tiene un cilindro vertical de paredes no aislantes, en cuyo interior se encuentra aire (considerado como un gas ideal diatómico). El cilindro tiene sección cuadrada de lado 4 cm y está cerrado por un pistón horizontal que puede deslizarse sin rozamiento.
Inicialmente el pistón se encuentra a una altura de 10 cm y el aire está en equilibrio térmico y mecánico con el exterior a una temperatura de 300 K y una presión 100 kPa.
Se procede entonces a efectuar el siguiente ciclo
- A→B El gas se comprime lentamente, colocando sobre la tapa el equivalente a 4 kg de arena, sin que se modifique la temperatura exterior.
- B→C Sin retirar la arena, se calienta lentamente el gas, hasta que el volumen vuelve a ser el inicial.
- C→D Manteniendo constante la nueva temperatura, se van retirando los granos de arena hasta que no queda ni uno.
- D→A Se enfría gradualmente el gas, hasta que su volumen vuelve a ser el inicial.
A la vista de este ciclo:
- Represente gráficamente el ciclo en un diagrama pV.
- Para cada uno de los pasos, halle (tomando
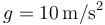 )
)
- El trabajo y el calor que se intercambian, indicando si cada uno entra en el sistema o sale de él.
- La variación de la energía interna y de la entalpía del gas en cada paso.
- Calcule el trabajo neto que desarrolla el sistema sobre el entorno.
- Halle el calor total absorbido por el gas (sin descontar el que cede al entorno).
- Calcule el rendimiento del ciclo, definido como:
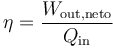
2 Representación gráfica
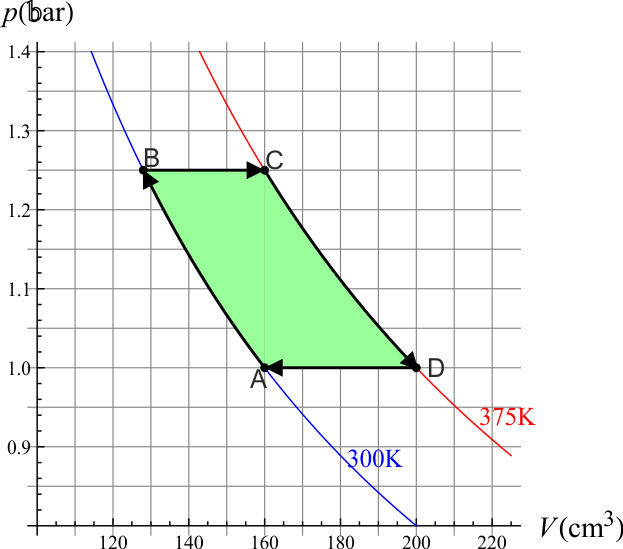
Aunque es fácil hacer una representación gráfica esquemática, vamos a construir una exacta empleando los valores de los diferentes estados del ciclo, así como las curvas que los unen.
2.1 A→B
En el primer paso tenemos que se va aumentando lentamente la presión sobre el gas, manteniéndose constante la temperatura. El proceso es una compresión isoterma, que podemos suponer cuasiestática. En todo momento se cumple la ley de Boyle
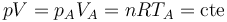
Gráficamente, el proceso se representa por un arco de hipérbola. El estado inicial corresponde a una presión y un volumen
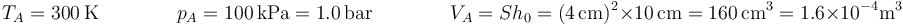
El estado final B tiene la misma temperatura, mientras que su presión aumenta en la cantidad correspondiente al peso añadido
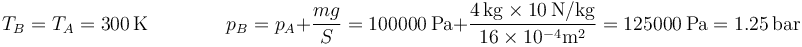
Este resultado no es muy exacto porque hemos tomado g = 10m/s² en vez de g = 9.8m/s², pero por una mayor simplicidad en los cálculos, lo mantendremos así.
El volumen de este estado B lo hallamos aplicando la ley de Boyle (caso particular de la ley de los gases ideales)
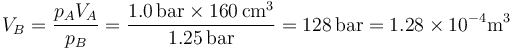
Esto quiere decir que la nueva altura del pistón es
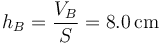
La presión ha aumentado en un 25% y el pistón ha bajado en un 20% de su anterior altura.
2.2 B→C
En el segundo proceso se aumenta la temperatura, pero el pistón puede moverse. Esto quiere decir que se trata de una expansión a presión constante. Gráficamente corresponde a un segmento horizontal en un diagrama pV.
El estado inicial B de este segmento ya lo tenemos
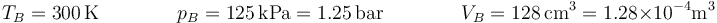
El final C lo hallamos teniendo en cuenta que su presión es la misma que la de B y su volumen el mismo que el inicial
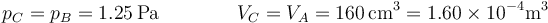
La nueva temperatura la hallamos aplicando la ley de Charles (caso particular de la de los gases ideales)
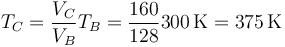
2.3 C→D
En el tercer paso la presión disminuye lentamente, hasta volver a ser la presión inicial, sin que cambie la temperatura. Al tratarse de una expansión isoterma cuasiestática, volvemos a tener un arco de hipérbola entre los estados C y D. Para el estado C tenemos
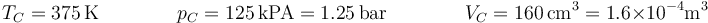
El estado final D tiene la misma temperatura que el C, y la misma presión que el A
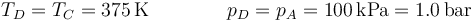
El volumen de este estado D lo hallamos aplicando la ley de Boyle (caso particular de la ley de los gases ideales)
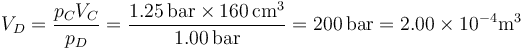
Esto quiere decir que la nueva altura del pistón es
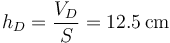
2.4 D→A
En el último paso se reduce la temperatura, con el pistón libre. La presión permanece constante, lo que implica un nuevo segmento inicial. El estado final A' tiene la misma presión que A y el mismo volumen que A, por lo que A' = A y el ciclo se cierra.
2.5 Resumen
Reuniendo los cuatro estados obtenemos la siguiente tabla
| Estado | Presión (bar) | Temperatura (K) | Volumen (cm³) | Altura (cm) |
|---|---|---|---|---|
| A | 1.00 | 300 | 160 | 10.0 |
| B | 1.25 | 300 | 128 | 8.0 |
| C | 1.25 | 375 | 160 | 10.0 |
| D | 1.00 | 375 | 200 | 12.5 |
y la siguiente representación gráfica:
3 Trabajo, calor y energía
A partir de los valores anteriores es fácil hallar cada una de las magnitudes energéticas, ya que al ser todos los procesos cuasiestáticos, poseen expresiones en función de la presión y volumen inicial y final de cada paso.
3.1 A→B
El primer paso es una compresión isoterma cuasiestática de un gas ideal. Puesto que no varía la temperatura, tampoco lo hace la energía interna
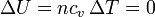
ni la entalpía
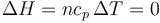
El trabajo no es nulo, ya que se comprime el gas. Su valor es, como corresponde a un proceso isotermo,
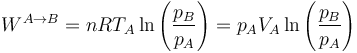
Sustituyendo los valores numéricos
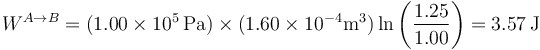
Este trabajo es positivo, por lo que entra en el sistema. Podemos ponerlo explícitamente como
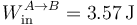
El calor lo calculamos aplicando el primer principio de la termodinámica
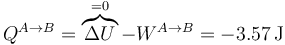
Este calor es negativo, por lo que sale del sistema. Lo escribimos entonces como
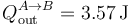
3.2 B→C
En el segundo paso se realiza trabajo a presión constante siendo su expresión
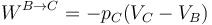
y su valor
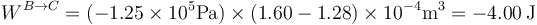
Este trabajo es negativo porque lo realiza el sistema sobre el entorno
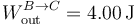
Por ser un proceso a presión constante podemos hallar el calor a partir de la variación de entalpía
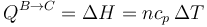
Sustituyendo la relación entre la capacidad calorífica y la constante de los gases ideales
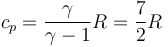
queda
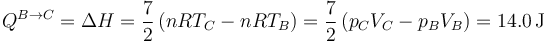
Este calor es positivo, ya que entra en el sistema
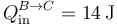
La variación de la energía interna la podemos obtener de
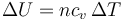
o como
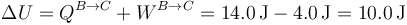
3.3 C→D
El tercer paso es una expansión isoterma cuasiestática de un gas ideal. Puesto que aquí tampoco varía la temperatura, no cambiae la energía interna
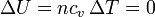
ni la entalpía
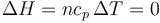
El trabajo no es nulo, ya que el gas se expande, empujando a la atmósfera. Vale
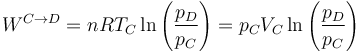
Sustituyendo los valores numéricos
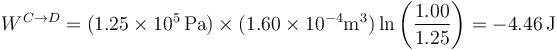
Este trabajo es negativo, por lo que sale del sistema. Podemos ponerlo explícitamente como
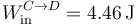
El calor lo calculamos aplicando el primer principio de la termodinámica
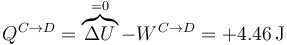
Este calor es positivo, por lo que entra en el sistema. Lo escribimos como
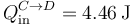
3.4 D→A
En el último paso se realiza trabajo a presión constante de nuevo
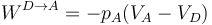
y su valor
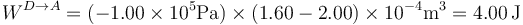
Este trabajo es positivo; lo realiza el entorno sobre el sistema
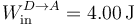
Por ser un proceso a presión constante podemos hallar el calor a partir de la variación de entalpía
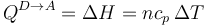
y queda
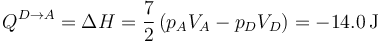
Este calor es negativo; sale del sistema
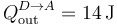
La variación de la energía interna la podemos obtener de
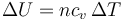
o como
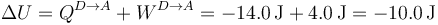
3.5 Resumen
Vemos que en dos de los pasos se realiza trabajo sobre el sistema y en los otros dos es el sistema el que lo realiza sobre el ambiente, siendo mayor el trabajo que sale que el que entra. Para el calor ocurre lo contrario, también entra en dos y sale en dos, pero es mayor lo que entra que lo que sale. Por tanto, este ciclo transforma una entrada neta de calor en una salida neta de trabajo. Describe entonces un tipo de motor. A este ciclo y el motor correspondiente se les denomina de Ericsson, por su inventor.
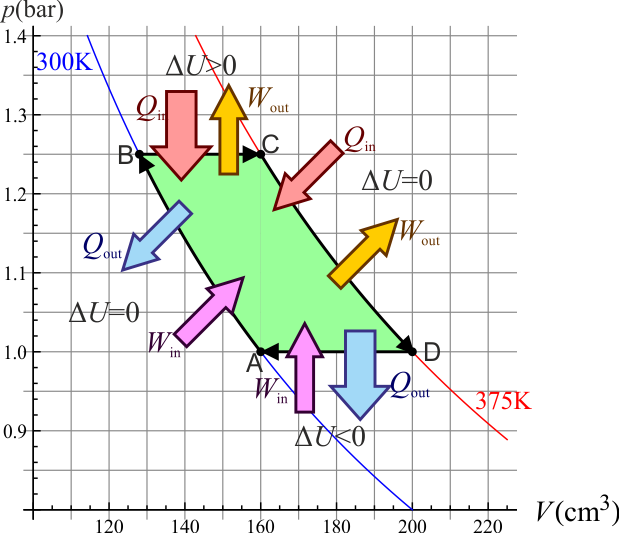
Para la energía interna y la entalpía hay dos pasos en que no cambian y uno en que aumentan y otro en que disminuyen, siendo la disminución igual al aumento. De esta forma, la variación neta a lo largo del ciclo es nula.
En forma de tabla
| Proceso | W(J) | Win(J) | Wout(J) | Q(J) | Qin(J) | Qout(J) | ΔU(J) | ΔH(J) |
|---|---|---|---|---|---|---|---|---|
| A→B | +3.57 | 3.57 | -3.57 | 3.57 | 0 | 0 | ||
| B→C | −4 | 4.0 | +14.0 | 14.0 | +10.0 | +14.0 | ||
| C→D | −4.46 | 4.46 | +4.46 | 4.46 | 0 | 0 | ||
| D→A | +4.0 | 4.0 | -14.0 | 14.0 | -10.0 | -14.0 |
4 Trabajo neto
El trabajo neto que sale del sistema es el que bruto que sale menos el que entra
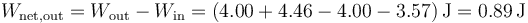
El trabajo neto es igual al área de la figura encerrada por el ciclo.
5 Calor total absorbido
El calor total absorbido no es el neto, sino solo la suma de los dos que entran en el sistema
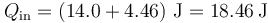
El calor que sale del sistema y es desechado en el ambiente vale
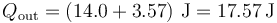
6 Rendimiento
El rendimiento del ciclo, considerado como el de una máquina térmica, es el cociente de las dos cantidades anteriores
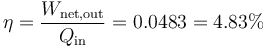
Vemos que menos del 5% del calor que entra se convierte en trabajo.
Este rendimiento puede también hallarse como
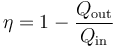
El rendimiento máximo que podría tener una máquina entre estas las temperaturas extremas es
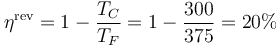
con lo cual la eficiencia del ciclo es algo menos del 25% de la máxima posible.
Este ciclo puede hacerse más eficiente con ayuda de la regeneración.





