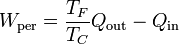Segundo principio de la termodinámica (GIE)
De Laplace
Contenido |
1 Introducción
El primer principio de la termodinámica establece que la energía interna puede aumentar porque se realice trabajo sobre el sistema o porque se introduzca calor en él. Desde este punto de vista calor y trabajo son equivalentes. Sin embargo, la experiencia diaria nos muestra que no es así, sino que existe una diferencia esencial entre ambos mecanismos de transferencia de energía. Podemos trasformar todo el trabajo en calor, pero no podemos transformar todo el calor en trabajo (si descendemos por una cuerda nos calentamos las manos, pero si nos calentamos las manos poniéndolas al sol, esto no nos hace subir la cuerda).
Igualmente, la experiencia nos muestra que existe una dirección en el que ocurren los fenómenos. Sabemos que el calor va de los cuerpos calientes a los fríos y no al revés; que un gas tiende a expandirse ocupando todo el volumen posible, y no a contraerse; que por consecuencia de la fricción los cuerpos se paran, no se aceleran.
Este sentido de evolución de los sistemas no está contenido en el primer principio de la termodinámica, sino que requiere un principio adicional, conocido como Segundo Principio de la Termodinámica.
2 Enunciado de Clausius
El enunciado de Clausius del Segundo Principio de la Termodinámica prohíbe la existencia de refrigeradores ideales
Es imposible un proceso que tenga como único resultado el paso de calor de un foco frío a un foco caliente
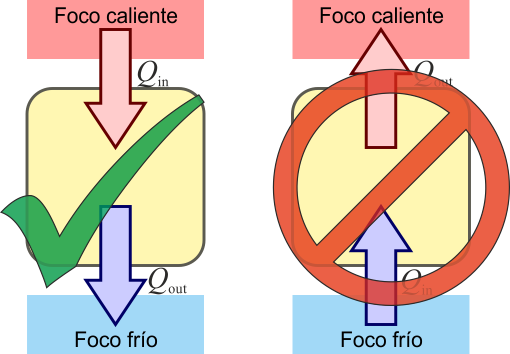
Como el enunciado de Kelvin-Planck, el enunciado de Clausius está formulado de manera negativa. Expresa un hecho empírico. En términos llanos, el enunciado de Clausius nos dice que para enfriar algo por debajo de la temperatura ambiente es necesario un trabajo adicional, esto es, que un frigorífico no funciona si no se enchufa
El enunciado de Clausius establece un sentido para la propagación del calor. Éste fluye de manera espontánea de los cuerpos calientes a los fríos, nunca a la inversa.
3 Enunciado de Kelvin-Planck
A la hora de aumentar la eficiencia de una máquina, el primer objetivo sería reducir, o eliminar si es posible, el calor de desecho Qout.
Se pueden plantear dos posibilidades
- ¿Es posible eliminar el condensador y que una máquina térmica que no genere calor de desecho, sino que todo el calor absorbido se transforme en trabajo neto? Por ejemplo, podría usarse la turbina para enfriar directamente el vapor y reenviarlo a la caldera, sin pasar por un condensador donde se ceda calor al ambiente sin realizar trabajo útil.
- ¿Es posible una reutilización del calor de desecho, de forma que se haga recircular y se incluya en el calor absorbido? La idea sería que el calor de desecho contribuya a calentar el vapor, en lugar de arrojarlo al exterior.
La respuesta a ambas preguntas es negativa.
El enunciado de Kelvin-Planck del Segundo Principio de la Termodinámica es el siguiente:
Es imposible construir una máquina que, operando en un ciclo, produzca como único efecto la extracción de calor de un foco y la realización de una cantidad equivalente de trabajo
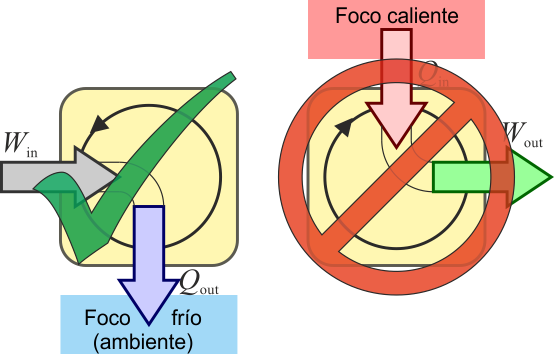
Este enunciado refleja un hecho empírico y no se deduce de ninguna ley previa.
El enunciado de Kelvin-Planck afirma que es imposible construir una máquina que tenga un rendimiento del 100%. Siempre habrá calor de desecho que, en la mayoría de los casos equivale a más de la mitad del calor absorbido.
Es importante señalar que el enunciado de Kelvin-Planck habla de procesos cíclicos, que dejan al sistema en un estado final igual al inicial. Sí es posible transformar calor en trabajo si el estado final es diferente del inicial. Por ejemplo en una expansión isoterma de un gas, todo el calor que entra se transforma íntegramente en trabajo, pero al final el volumen del gas es diferente del inicial.
4 Equivalencia entre enunciados
Es fácil probar que el enunciado de Kelvin-Planck y el de Clausius son equivalentes, aunque hablen de cosas completamente diferentes (uno del rendimiento de máquinas térmicas y el otro de la dirección en que fluye el calor). Para ello basta suponer que uno de ellos no se cumple y demostrar que ello implica que el otro tampoco. Al efectuar la demostración en los dos sentidos, se llega a que son equivalentes.
Supongamos en primer lugar que no se verifica el enunciado de Kelvin-Planck, es decir, existe una máquina que transforma íntegramente el calor en trabajo. En ese caso basta con utilizar un trabajo para alimentar un refrigerador
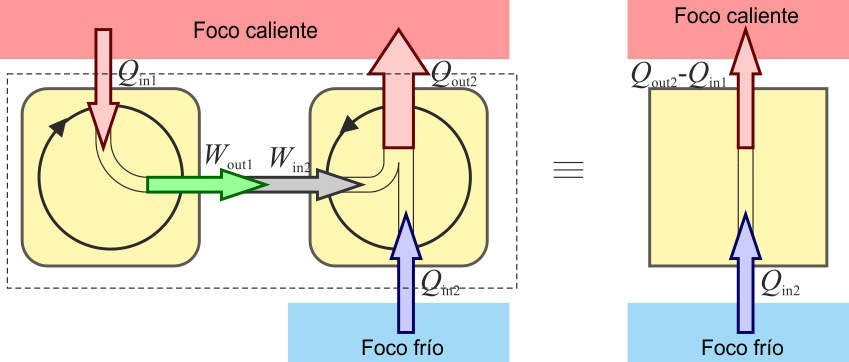
De esta forma el trabajo se emplea en absorber una cierta cantidad de calor del foco frío y cederla al foco caliente. Si ahora consideramos el conjunto de las dos máquinas como un solo dispositivo ya no hay trabajo en el sistema (ya que sería puramente interno) el único efecto sería el trasvase de calor del foco frío al caliente. Esto constituye una violación del enunciado de Clausius. Por tanto, si no se cumple el enunciado de Kelvin-Planck tampoco se cumple el de Clausius.
Supongamos ahora que no se cumple el enunciado de Clausius y que existe un proceso que es capaz de absorber calor de un foco frío y cederlo a uno caliente. En este caso, nos basta con usar este dispositivo como “bomba de achique” para devolver el calor de desecho de una máquina térmica al foco caliente. En ese caso el resultado neto es que una cierta cantidad de calor se convierte íntegramente en trabajo, lo que constituye una violación del enunciado de Kelvin-Planck.
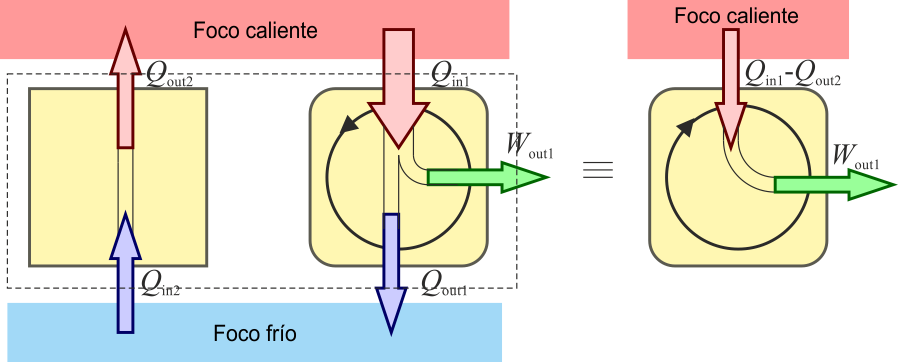
Por tanto, si no se cumple el primero no se cumple el segundo y viceversa. O los dos enunciados son ciertos (lo que corrobora la experiencia hasta el momento) o los dos son falsos.
Podemos ver cómo los dos enunciados se relacionan en la práctica. Una de las posibilidades teóricas que podrían plantearse para mejorar el rendimiento de una máquina de vapor sería enviar el calor de desecho en lugar de al ambiente, a la caldera, permitiendo el aprovechamiento de todo el calor que entra en la máquina. Sabemos que esto viola el enunciado de Kelvin-Planck. Es fácil ver que también viola el de Clausius: el vapor realiza trabajo moviendo la turbina. Al hacerlo se enfría, ya que el trabajo se hace a costa de la energía interna del vapor. Por tanto, el vapor que llega al condensador está más frío que el que sale de la caldera. Para reconducir el calor del condensador a la caldera tendríamos que hacer pasar calor de un punto más frío a uno más caliente, lo cual es imposible.
5 Procesos reversibles e irreversibles
El segundo principio establece que existen procesos que pueden recorrerse en un sentido, pero no el opuesto. Podemos transformar íntegramente el trabajo en calor (es lo que hace una estufa de resistencias), pero no el calor en trabajo (ya que lo prohíbe el enunciado de Kelvin-Planck). Los ejemplos cotidianos abundan: si colocamos una taza de café caliente en el ambiente, el café se enfría, nunca se calienta más. Si vertemos azúcar en agua, no podemos invertir la disolución.
El Segundo Principio, por tanto, permite clasificar los procesos en reversibles e irreversibles. Existen dos formas de definir los procesos reversibles, que expresan el mismo hecho, pero no se ha probado que sean equivalentes.
- Un proceso reversible es aquel:
- que se puede recorrer en los dos sentidos, pasando exactamente por los mismos estados, de forma que el estado final del sistema y del entorno sea exactamente igual al inicial, es decir, que el proceso se puede deshacer sin dejar ninguna huella.
- cuyo sentido puede invertirse mediante un cambio infinitesimal de las condiciones del entorno.
Un proceso irreversible es el que no es reversible.
Una violación de la primera definición sería la siguiente: imaginemos un cilindro con dos cámaras, estando una llena de aire y en la otra se ha hecho el vacío. Las cámaras están separadas por un diafragma. La cámara vacía está limitada por un pistón que puede moverse.



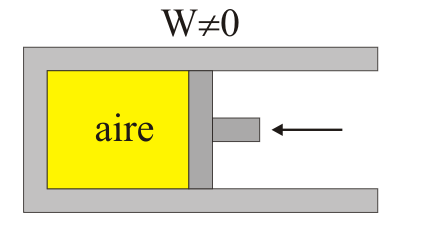
Si mediante una perforación dejamos que escape el aire a la cámara vacía, no se realiza trabajo alguno, ya que no hay presión externa. Si ahora devolvemos el aire a su tamaño inicial con el pistón, debemos realizar un trabajo. Por tanto el proceso es irreversible, ya que aunque el sistema ha vuelto a su estado inicial, el entorno no lo ha hecho, ya que ha debido realizar un trabajo neto (y ha absorbido una cantidad equivalente de calor).
Como ejemplo de la segunda versión sea un sistema formado por un recipiente con agua en equilibrio térmico con hielo a 1 atm de presión. El sistema estará a 0.00°C.
Supongamos que el conjunto se encuentra rodeado por un baño térmico a +0.01°C. Sabemos que el hielo se irá derritiendo progresivamente, pasando a ser agua líquida. Si ahora cambiamos la temperatura exterior a -0.01°C, el hielo volverá a crecer, a costa de la congelación de agua. Hemos invertido el proceso mediante un cambio infinitesimal del entorno y el proceso es reversible.
Si en cambio el baño exterior está a 20.01°C sabemos que el hielo se derretirá. Si ahora pasamos la temperatura exterior a 19.99°C el hielo se seguirá derritiendo, por lo que no se invierte el proceso. Este proceso es irreversible.
Más en general, siempre que tengamos una diferencia finita de temperaturas entre un sistema y su entorno o entre diferentes partes de un sistema, tendremos un proceso irreversible.
Un razonamiento análogo se puede hacer analizando la expansión de un gas frente a una presión exterior. Si hay una diferencia finita de presiones es irreversible, si la diferencia es infinitesimal será reversible.
“Reversible” no es lo mismo que “cuasiestático”. Todos los procesos reversibles deben ser cuasiestáticos, pero no todos los cuasiestáticos son reversibles. Por ejemplo, un café inicialmente a 40°C que que deja metido en un termo, estando el ambiente a 20°C, se va enfriando gradualmente; podrá enfriarse muy poquito a poco, de manera aproximadamente cuasiestática, pero irreversible.
Todos los procesos reales son irreversibles, si bien existen procesos más o menos ideales, que se acercan a la reversibilidad. Los procesos reversibles permiten establecer además criterios de máximos o mínimos para los procesos reales. Por ejemplo, el máximo rendimiento de una máquina térmica se obtiene si esta opera reversiblemente.
Existen numerosas causas de irreversibilidad, mecánicas, térmicas, químicas,… A su vez, pueden ser externas o internas.
- Irreversibilidad interna
- es la que se produce dentro del sistema, debido a que este no se encuentra en equilibrio. Por ejemplo, al comprimir un gas bruscamente, el gas próximo al pistón posee una presión mayor que los puntos alejados (produciéndose una onda de sonido). En este momento el gas no se encuentra en equilibrio (no existe la “presión del sistema”) y evoluciona de forma irreversible. Otro ejemplo sería la inmersión de un trozo de hielo en agua caliente, la diferencia finita de temperaturas entre partes de un sistema provoca irreversibilidad
- Irreversibilidad externa
- es aquella en la que quizás el sistema evoluciona reversiblemente, por ejemplo, porque su temperatura varía lentamente (como le ocurre al café contenido en un termo), pero aun así el proceso es irreversible porque la interacción con el entorno es irreversible (en el caso del café, porque existe una diferencia finita de temperaturas entre el interior del termo y el ambiente).
Así, tenemos:
- Irreversibilidad mecánica:
- Externa: Se deben a la transformación de trabajo en calor por la interacción del sistema con el entorno. El ejemplo más sencillo es la fricción. Consideremos el movimiento de ida y vuelta de un pistón en un cilindro, que roza tanto a la ida como a la vuelta. Es un proceso cíclico que transforma trabajo en calor. Su inversión significaría la transformación cíclica de calor en trabajo, lo que es imposible. Por ello, todo proceso mecánico que implique fricción (esto es, todos) es irreversible.
- Interna: Se debe a la conversión de trabajo en calor en el interior del sistema. Puede ser por fricción interna. Otro ejemplo es la expansión libre de un gas (el experimento de Joule). No hay trabajo ni intercambio de calor con el sistema, pero el proceso es irreversible.
- Irreversibilidad térmica:
- Externa: Se debe al intercambio de calor con el exterior de forma irreversible. El caso más importante es debido a una diferencia finita de temperaturas con el entorno. Su inversión implicaría que el calor debe pasar del cuerpo más frío al más caliente, lo que viola el enunciado de Clausius. Solo cuando es infinitesimal la diferencia de temperatura entre el sistema y su entorno puede producirse una transferencia reversible de calor.
- Interna: Debido a las transferencias de calor entre distintas partes de un mismo sistema.
- Otras irreversibilidades: Aparte de las mecánicas y térmicas tenemos irreversibilidades químicas (debidas a las reacciones espontáneas), de mezclas y disoluciones, la producción de calor por efecto Joule, etc.
Como vemos, son tantas las causas de irreversibilidad que es difícil imaginar un proceso reversible. Debe ser cuasiestático (para que el sistema esté siempre en equilibrio), sin fricción, manteniendo en todo momento la misma temperatura que el exterior, etc. Por ello los procesos reversibles son solo idealizaciones útiles.
De la irreversibilidad térmica se deduce que una condición necesaria para que un proceso sea reversible debe ser:
- Si hay intercambio de calor, el proceso debe ser isotermo (debe haber una diferencia infinitesimal de temperatura entre el sistema y su ambiente).
- Recíprocamente, si existe una diferencia finita de temperaturas entre el sistema y el ambiente, el proceso debe ser adiabático.
Un proceso reversible tiene la ventaja teórica de que, como su nombre indica, puede invertirse su recorrido. Entonces, podemos considerar un camino que va de A a B y uno de B a A exactamente por la misma curva, de manera que
Con los irreversibles no se puede hacer esto, ya que el camino inverso a uno irreversible no existe. Podremos devolver el sistema a su estado inicial pero por otro proceso y realizando un trabajo diferente.
6 Máquinas térmicas reversibles
Una máquina reversible es una que puede operar en ambos sentidos, esto es, tanto como motor como como refrigerador. Esta máquina debe funcionar describiendo una serie de procesos cada uno de los cuales debe ser reversible (esto es, son procesos cuyo sentido de evolución se puede invertir mediante un cambio infinitesimal de las condiciones del entorno).
El concepto de máquina reversible, como el de proceso reversible, es una idealización. No existen máquinas reversibles en el mundo real, sino que deben considerarse como el límite al que tienden máquinas irreversibles cada vez más perfeccionadas.
El ejemplo más sencillo de máquina reversible es el de la máquina de Carnot, la cual opera según un ciclo de Carnot reversible. En un ciclo de Carnot tenemos
- Una compresión y una expansión isotermas; si en cada una la temperatura del sistema es la misma del ambiente, pueden ser reversibles, aunque haya intercambio de calor.
- Una compresión y una expansión adiabáticas. En estas, aunque haya una diferencia finita de temperaturas con el ambiente, no se intercambia calor, por lo que pueden ser reversibles.
Por supuesto, la reversibilidad del ciclo de Carnot requiere además que se eliminen todas las irreversibilidades mecánicas. Por ello, se trata de un motor puramente ideal. Cuando esta máquina se invierte se convierte en un refrigerador (o bomba de calor) de Carnot.
El rendimiento de una máquina de Carnot reversible es
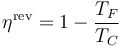
Esto quiere decir que si tenemos una máquina de Carnot que opera entre dos temperaturas y absorbe un calor Qin el trabajo que realiza vale
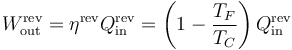
y el calor que desecha es
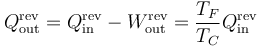
Si ahora a esa máquina reversible le damos la vuelta y la convertimos en un refrigerador, el calor que absorbe es el que antes emitía. El trabajo necesario para operar es el mismo que antes producía y el calor que ahora desecha es el que antes absorbía
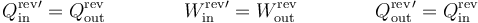
cumpliéndose en ese caso las relaciones
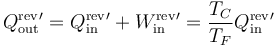
mientras que el coeficiente de desempeño de un refrigerador de Carnot vale
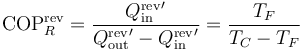
7 Teorema de Carnot
El teorema de Carnot es un enunciado alternativo del Segundo Principio de la termodinámica, que se formula a partir de la comparación entre máquinas reversibles y máquinas irreversibles como:
El rendimiento de una máquina térmica M que opere entre dos focos no puede ser superior que el de una máquina reversible R que opere entre los mismos focos
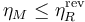
cumpliéndose la igualdad si la máquina M es también reversible y la desigualdad si es irreversible.
Puede demostrarse que el teorema de Carnot es equivalente al enunciado de Clausius. Ello se hace por reducción al absurdo.
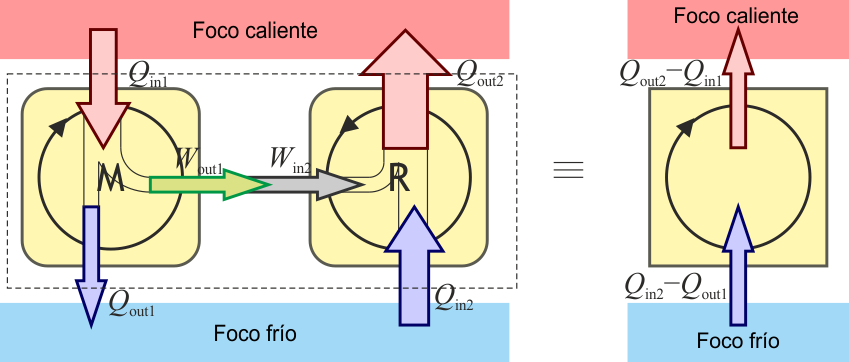
Supongamos que la máquina M tiene una eficiencia mayor que la reversible. En este caso, para la misma cantidad de trabajo neto producido (pongamos una potencia de 600 MWe), M necesita menos calor que R (si R requiere 1200 MWt, pongamos que M requiere solo 1000 MWt). Entonces, si le damos la vuelta a R y la convertimos en refrigerador podríamos emplear la máquina M para hacerlo funcionar. En ese caso el resultado neto sería que estamos tomando calor del foco frío (200 MWt en nuestro ejemplo) y llevándolo al caliente, lo cual viola el enunciado de Clausius. Por tanto debe cumplirse el teorema de Carnot.
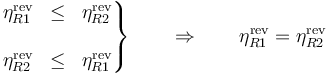
Si se trata de dos máquinas reversibles R1 y R2 entonces podemos darle la vuelta a cualquiera de ellas, por lo que se cumple
El teorema de Carnot es equivalente al de Kelvin-Planck, pero da un resultado mucho más concreto que éste.
El de Kelvin-Planck simplemente nos dice que no existe la máquina perfecta con rendimiento del 100%. El teorema de Carnot nos dice además que existe un máximo para ese rendimiento e incluso establece cómo hallar ese máximo. Basta con calcular el rendimiento de una máquina reversible que actúe entre las dos temperaturas indicadas.
Máquinas reversibles puede haber muchas con diferentes soportes (solo gas, agua y vapor, materiales magnéticos,…) por lo que puede resultar sorprendente que el rendimiento de todas ellas sea el mismo si trabajan entre las mismas temperaturas.
Puesto que ya conocemos una máquina reversible, la de Carnot, este teorema nos da un límite preciso para el rendimiento de una máquina térmica
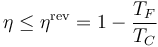
Llegado al límite del rendimiento fijado por el teorema de Carnot, la única forma de aumentar este rendimiento es o bien bajando la temperatura del foco frío (lo cual suele ser imposible, al tratarse del ambiente) o elevar la del foco caliente.
Para una entrada de calor dada, el teorema de Carnot establece un valor máximo del trabajo
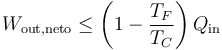
y un valor minimo del calor de desecho
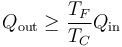
Equivalentemente, si lo que tenemos es el trabajo producido, nos da valores mínimos para el calor consumido y para el calor de desecho.
7.1 Aplicación a refrigeradores y bombas de calor
La aplicación del teorema de Carnot a un refrigerador establece que el COP máximo lo da un refrigerador que opere según un ciclo reversible, como el de Carnot. Este valor máximo es
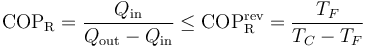
Para un frigorífico que mantiene los productos a 5°C en una habitación a 22°C este valor máximo es 16.4. Un frigorífico real posee un COP en torno a 4.
Esto quiere decir que el COP de un refrigerador no tiene un valor ilimitado, sino que se encuentra acotado en el rango
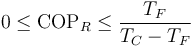
Para una bomba de calor, el COP máximo lo da también una bomba reversible, siendo su valor máximo
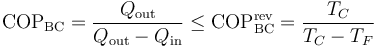
Una bomba de calor que mantiene una habitación a 22°C mientras el exterior está a 5°C tiene un coeficiente de desempeño máximo de 17.4 (uno más que para el frigorífico).
Esto da el rango de valores admisibles para el COP de una bomba de calor
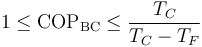
8 Rendimiento de la segunda ley
Puesto que el rendimiento de una máquina M siempre va a ser menor o igual que el de una máquina reversible R que opere entre las misma temperaturas, puede definirse el rendimiento relativo al máximo posible
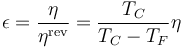
Este rendimiento relativo se conoce como rendimiento de la segunda ley y nos informa de cómo de eficiente es una máquina comparado con lo que podría alcanzar teóricamente.
Así, si tenemos dos máquinas diferentes, ambas con un rendimiento del 30%, pero la primera opera entre 300K y 600K, mientras que la segunda opera entre 300K y 1200K, entonces la primera máquina es más eficiente que la segunda, ya que

y la primera máquina está más cerca del ideal que la segunda.
Análogamente pueden definirse los coeficientes de desempeño de la segunda ley, como la proporción respecto al máximo posible de un refrigerador o una bomba de calor reversibles.
9 Trabajo perdido
9.1 Para una máquina térmica
El que el rendimiento de una máquina térmica sea siempre inferior al de una máquina reversible permite definir el trabajo perdido como la diferencia entre el que podría haber realizado la máquina y que realiza de verdad.
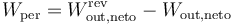
Podemos expresar este resultado en función del calor que entra y sale de la máquina
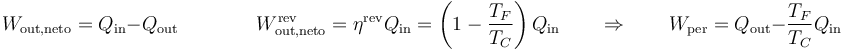
Vemos que el trabajo perdido equivale a la diferencia entre el calor de desecho que se produce realmente y el que se produciría si la máquina fuera óptima.
9.2 Para un refrigerador
De la misma manera, puede calcularse el trabajo extra necesario para hacer funcionar un refrigerador por el hecho de no ser reversible.
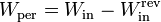
Para la misma cantidad de calor extraído, esta diferencia es igual a la diferencia entre el calor de desecho en un refrigerador real y uno ideal
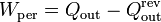
En un refrigerador reversible se cumple
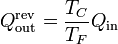
por lo que el trabajo perdido es igual a
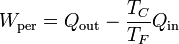
9.3 Para una bomba de calor
Operando igualmente para una bomba de calor
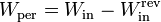
Para la misma cantidad de calor vertida al foco frío, este trabajo equivale a la diferencia entre el calor que se extrae en un caso y en otro
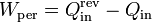
En el caso reversible
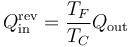
por lo que