Proceso irreversible de 4 pasos
De Laplace
Contenido |
1 Enunciado
Una cierta cantidad de aire seco (considerado como gas ideal diatómico) se encuentra contenido en un cilindro de sección cuadrada de 10 cm de lado, cerrado por un pistón móvil situado inicialmente a 16 cm del fondo. El aire interior se encuentra inicialmente (estado A) a 300 K de temperatura (que es la del ambiente en todo momento) y a la presión atmosférica de 0.1 MPa.
Se le aplica a este gas el siguiente proceso cíclico
- A→B Se aumenta bruscamente la presión aplicada a 0.8 MPa, de forma que se produce una compresión muy rápida, que puede aproximarse por un proceso adiabático irreversible.
- B→C Manteniendo la presión exterior de 0.8 MPa se espera hasta que vuelva a alcanzar el equilibrio térmico con el ambiente.
- C→D Se retira bruscamente la presión exterior, dejándola en su valor inicial de 0.1 MPa. Se produce una expansión brusca que puede aproximarse por un proceso adiabático irreversible.
- D→A Manteniendo la presión exterior de 0.1 MPa se espera hasta que vuelva a alcanzar el equilibrio térmico con el ambiente.
Para este ciclo
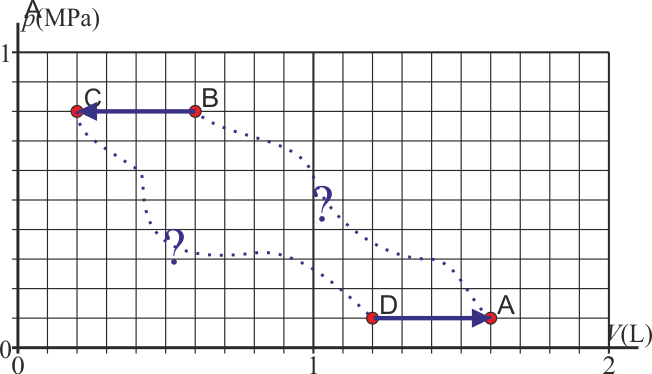
- Calcule los valores de la presión, volumen y temperatura al final de cada paso. Indique los estados, así como los procesos oportunos en un diagrama pV
- Halle el trabajo y el calor que entran en el sistema en cada paso, así como las variaciones de energía interna y entalpía en cada uno.
- Calcule, para un ciclo completo, el trabajo que entra y el que sale del sistema, así como el calor que entra y el que sale.
- ¿Es este sistema un refrigerador? ¿Una máquina térmica? ¿Una estufa?
2 Presiones, volúmenes y temperaturas
Inicialmente tenemos el estado definido por
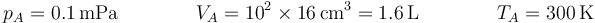
2.1 Proceso A→B
En el primer paso, la presión exterior aumenta bruscamente y a partir de ahí se mantiene constante. Tal como se describe en el apartado teórico correspondiente y en un problema similar, al ser un proceso adiabático se cumple
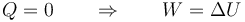
Por ser una compresión a presión constante, el trabajo es igual a
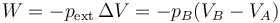
y el aumento de la energía interna
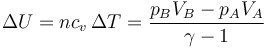
Igualando estas dos cantidades y despejando obtenemos el volumen en el estado B&rarr
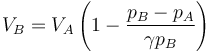
siendo su valor numérico
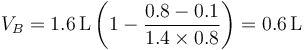
Una vez que tenemos la presión y el volumen hallamos la temperatura en este estado
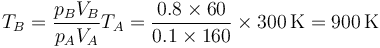
2.2 Proceso B→C
El segundo paso es un enfriamiento a presión constante hasta que la temperatura vuelve a ser la inicial

Hallamos el nuevo volumen por la ley de los gases ideales, que entre los estados A y C se reduce a la ley de Boyle
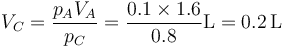
También podíamos haber relacionado los estados B y C, y en ese caso habríamos usado la ley de Charles.
2.3 Proceso C→D
Tenemos un nuevo proceso adiabático irreversible en el que la presión permanece constante, por lo que podemos aplicar una fórmula análoga a la del primer paso
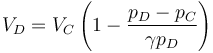
con
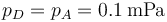
2.4 Proceso D→A
2.5 Tabla resumen
| Estado | p (MPa) | V (L) | T (K) |
|---|---|---|---|
| A | 0.1 | 1.6 | 300 |
| B | 0.8 | 0.6 | 900 |
| C | 0.8 | 0.2 | 300 |
| D | 0.1 | 1.2 | 225 |
3 Cambios energéticos
| Paso | Q (J) | W (J) | ΔU (J) | ΔH (J) |
|---|---|---|---|---|
| A→B | 0 | +800 | +800 | +1120 |
| B→C | −1120 | +320 | −800 | −1120 |
| C→D | 0 | −100 | −100 | −140 |
| D→A | +140 | −40 | +100 | +140 |
4 Entrada y salida de calor y trabajo







