Variación de entropía por compresión
De Laplace
Contenido |
1 Enunciado
Considere un prisma vertical de 4 cm de lado que contiene aire. El cilindro contiene un pistón que inicialmente está a 10 cm de altura. La temperatura del gas inicialmente es de 300 K, que también es la temperatura ambiente y la presión exterior es de 100 kPa.
Calcule la variación en la entropía del gas, del entorno y del universo en los cuatro siguientes procesos:
- Se coloca bruscamente una pesa de 4 kg encima del émbolo y las paredes son diatermas.
- Se colocan progresivamente 4 kg de arena, grano a grano y las paredes son diatermas.
- Se coloca bruscamente una pesa de 4 kg encima del émbolo y las paredes son adiabáticas.
- Se colocan progresivamente 4 kg de arena, grano a grano y las paredes son adiabáticas.
2 Introducción
En este problema tenemos cuatro variantes del mismo sistema, que son muy similares en apariencia, pero difieren en detalles cruciales que provocan que los resultados sean distintos en cada uno de los casos.
Los cálculos analíticos (pero no los valores numéricos) del trabajo y calor en estos cuatro procesos se consideran además en los problemas “Trabajo en una compresión isoterma por un peso” y “Compresión adiabática de un gas por un peso”.
En todos los casos tenemos inicialmente un gas en un estado A en el que ocupa un cierto volumen a una cierta presión y temperatura iguales a las del ambiente
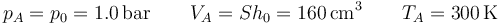
Asimismo, en las cuatro situaciones se añade una pesa que incrementa la presión sobre el gas a un valor
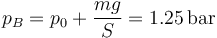
(aproximando g por 10 m/s²). La temperatura y volumen final, en cambio, dependen del proceso que consideremos.
3 Compresión isoterma irreversible
En el primer caso, el recipiente no está aislado del exterior, por lo que una vez se deja caer la pesa y se alcanza de nuevo el equilibrio, su temperatura final es igual a la inicial
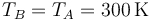
Puesto que tenemos la presión y la temperatura tenemos automáticamente el volumen, por la ley de los gases ideales (o, en este caso particular, la ley de Boyle)
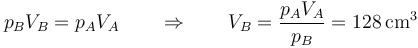
En términos de la nueva altura del pistón
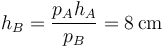
Para calcular la variación de entropía tenemos que hallar por separado la del sistema y la del ambiente.
3.1 Variación de entropía del ambiente
El ambiente es un foco térmico a temperatura constante T0. Su variación de entropía es la correspondiente a un proceso isotermo reversible
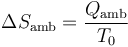
El calor que entra en el ambiente es el mismo que sale del sistema
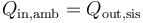
A su vez el calor que sale del sistema lo da el primer principio de la termodinámica
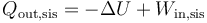
Por ser un proceso isotermo de un gas ideal, su variación de energía interna es nula
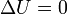
mientras que el trabajo se halla a parte de la integral de la presión exterior, que es constante (e igual a la final)
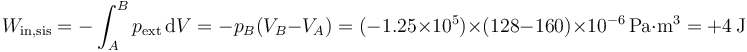
Es decir, en el sistema entran 4 julios en forma de trabajo, que no son almacenados, sino que vuelven a salir en forma de calor, entregando entropía al ambiente.
Por tanto, la variación de entropía del ambiente es
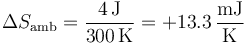
3.2 Variación de entropía del sistema
La fórmula anterior no nos vale para el cálculo de la variación de entropía del propio gas. No sabemos si la temperatura del sistema ha permanecido constante. Lo único que sabemos es que su temperatura inicial y final es la misma, pero en medio puede haber cambiado, incluso de forma no uniforme (calentándose algunos puntos más que otros).
Para hallar la variación de entropía del sistema podemos:
- imaginar un proceso reversible que lleve del estado inicial al mismo estado final.
- aplicar que la entropía es una función de estado y por tanto solo necesitamos conocer su valor final y su valor inicial.
El segundo método solo es aplicable cuando conocemos la entropía como función de las variables de estado. Para el caso de un gas ideal esto es posible. En función de la temperatura y la presión, la variación de entropía es
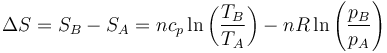
Puesto que la temperatura final es la misma que la inicial el primer término se cancela y queda
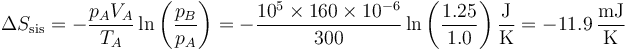
3.3 Variación total
Sumando las dos contribuciones
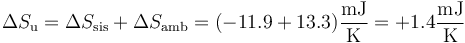
La variación de entropía del universo es estrictamente positiva, como corresponde a un proceso irreversible.





