Variación de entropía por compresión
De Laplace
Contenido |
1 Enunciado
Considere un prisma vertical de 4 cm de lado que contiene aire. El cilindro contiene un pistón que inicialmente está a 10 cm de altura. La temperatura del gas inicialmente es de 300 K, que también es la temperatura ambiente y la presión exterior es de 100 kPa.
Calcule la variación en la entropía del gas, del entorno y del universo en los cuatro siguientes procesos:
- Se coloca bruscamente una pesa de 4 kg encima del émbolo y las paredes son diatermas.
- Se colocan progresivamente 4 kg de arena, grano a grano y las paredes son diatermas.
- Se coloca bruscamente una pesa de 4 kg encima del émbolo y las paredes son adiabáticas.
- Se colocan progresivamente 4 kg de arena, grano a grano y las paredes son adiabáticas.
2 Introducción
En este problema tenemos cuatro variantes del mismo sistema, que son muy similares en apariencia, pero difieren en detalles cruciales que provocan que los resultados sean distintos en cada uno de los casos.
Los cálculos analíticos del trabajo y calor en estos cuatro procesos se consideran además en el problema “Trabajo en una compresión por un peso”
En todos los casos tenemos inicialmente un gas en un estado A en el que ocupa un cierto volumen a una cierta presión y temperatura iguales a las del ambiente

Asimismo, en las cuatro situaciones se añade una pesa que incrementa la presión sobre el gas a un valor

(aproximando g por 10 m/s²). La temperatura y volumen final, en cambio, dependen del proceso que consideremos.
3 Compresión isoterma irreversible
En el primer caso, el recipiente no está aislado del exterior, por lo que una vez se deja caer la pesa y se alcanza de nuevo el equilibrio, su temperatura final es igual a la inicial
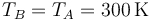
Puesto que tenemos la presión y la temperatura tenemos automáticamente el volumen, por la ley de los gases ideales (o, en este caso particular, la ley de Boyle)
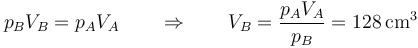
En términos de la nueva altura del pistón
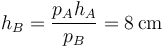
Para calcular la variación de entropía tenemos que hallar por separado la del sistema y la del ambiente.
El ambiente es un foco térmico a temperatura constante T0. Su variación de entropía es la correspondiente a un proceso isotermo reversible
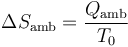
El calor que entra en el ambiente es el mismo que sale del sistema
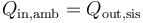
A su vez el calor que sale del sistema lo da el primer principio de la termodinámica
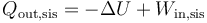
Por ser un proceso isotermo de un gas ideal, su variación de energía interna es nula
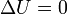
mientras que el trabajo se halla a parte de la integral de la presión exterior, que es constante (e igual a la final)
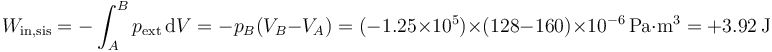
(los decimales finales resultan de hacer los cálculos exactos, con g = 9.81N/kg, aunque en su presentación se redondeen los resultados a tres cifras significativas). Es decir, en el sistema entran unos 4 julios en forma de trabajo, que no son almacenados, sino que vuelven a salir en forma de calor, entregando entropía al ambiente.
Por tanto, la variación de entropía del ambiente es
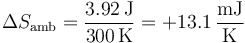
La fórmula anterior no nos vale para el cálculo de la variación de entropía del propio gas. No sabemos si la temperatura del sistema ha permanecido constante. Lo único que sabemos es que su temperatura inicial y final es la misma, pero en medio puede haber cambiado, incluso de forma no uniforme (calentándose algunos puntos más que otros).
Para hallar la variación de entropía del sistema podemos:
- imaginar un proceso reversible que lleve del estado inicial al mismo estado final.
- aplicar que la entropía es una función de estado y por tanto solo necesitamos conocer su valor final y su valor inicial.
El segundo método solo es aplicable cuando conocemos la entropía como función de las variables de estado. Para el caso de un gas ideal esto es posible. En función de la temperatura y la presión, la variación de entropía es
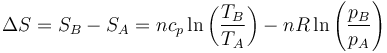
Puesto que la temperatura final es la misma que la inicial el primer término se cancela y queda
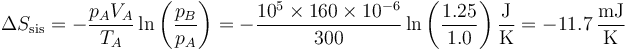
Vemos que no hay problema en que la variación de entropía del sistema sea negativa. Lo que debe ser positiva o nula es la variación de entropía del universo entero.
Sumando las dos contribuciones
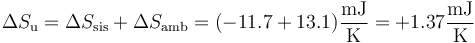
La variación de entropía del universo es estrictamente positiva, como corresponde a un proceso irreversible.
4 Compresión isoterma reversible
En el segundo caso, la presión y la temperatura finales son los mismos que en el primer caso

y por ello el volumen final también es el mismo que en el primer caso:
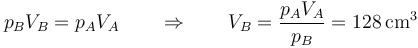
Puesto que el estado inicial es el mismo que en todos los casos y el estado final coincide con el el apartado anterior, la variación de entropía del sistema (que depende sólo de los estados) es la misma que allí
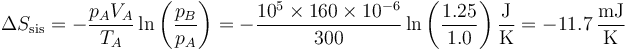
Para el ambiente la expresión general sigue siendo la misma
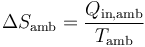
pero el calor que entra en el ambiente es diferente del de antes, ya que el trabajo realizado sobre el gas no es el mismo
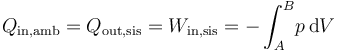
Por tratarse de un proceso isotermo cuasiestático
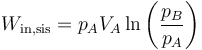
por lo que la variación de entropía del ambiente es ahora

Aplicando las propiedades de los logaritmos vemos que esta variación de entropía es igual en magnitud y de signo opuesto a la del sistema, por lo que

Aun que la variación de entropía del sistema es distinta de cero (negativa incluso), la del universo es nula, lo que nos indica que el proceso es reversible.
5 Compresión adiabática irreversible
En el tercer caso, el recipiente está aislado térmicamente. Por tanto, en el ambiente no entra ni sale calor y
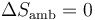
La variación de entropía del sistema, en cambio, no es nula, ya que el proceso es irreversible. Es más, por el principio del aumento de entropía, debe resultar una variación positiva.
Para calcular la variación de entropía del sistema debemos conocer su estado final. Este no es el mismo que el dos los dos apartados anteriores, ya que en este caso la temperatura cambia. Al estar aislado del exterior, no se pone en equilibrio térmico con éste.
Obtenemos el estado final a partir del primer principio de la termodinámica. Puesto que el proceso es adiabático
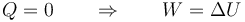
El trabajo que entra en el sistema, al ser la presión externa constante, vale

donde VB es desconocido. La variación de la energía interna es, por su parte,

Igualando y despejando
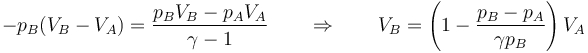
El valor numérico del nuevo volumen, teniendo en cuenta que γ = 1.4 para el aire, es

El pistón baja menos que en el caso anterior. La nueva temperatura final la obtenemos de la ley de los gases ideales

La temperatura del gas aumenta en 21°C.
La variación de entropía del sistema es ahora

El segundo término es el mismo de los apartados anteriores, pero el primero ya no es nulo, sino que vale
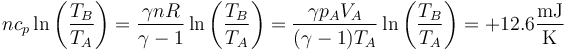
siendo la variación total de entropía del sistema
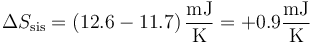
que de nuevo es positiva, por ser un proceso irreversible.
La condición de que la entropía debe aumentar nos establece un valor mínimo para la temperatura final. debe ser
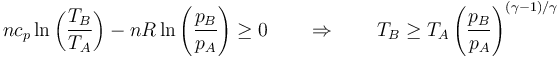
6 Compresión adiabática reversible
En el último caso, tenemos de nuevo un proceso adiabático. No se intercambia calor con el ambiente y

Para el sistema, el cálculo sigue la misma lógica que el del apartado anterior, pero hay que ir grano a grano, es decir, en forma diferencial,
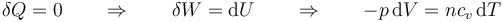
Aplicando la ley de los gases ideales
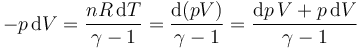
Si aquí agrupamos los términos obtenemos
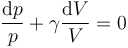
y una vez integrada nos da la ley de Poisson
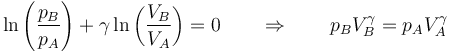
Despejamos de aquí el nuevo volumen
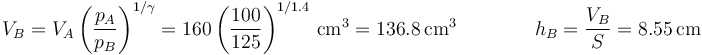
Vemos que se comprime un poco más que antes.
La nueva temperatura final del gas vale
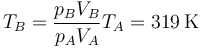
y se calienta un poco menos que en el caso anterior.
La variación de entropía del sistema es ahora
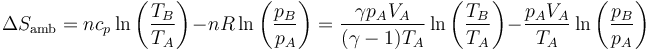
El segundo término vuelve a valer lo mismo que en los casos anteriores
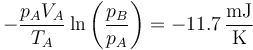
mientras que el primero vale

de forma que
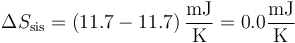
Puesto que la variación de entropía del ambiente es nula, obtenemos que la entropía del universo permance constante y el proceso es reversible.
En general, un proceso adiabático cuasiestático de un sistema es isentrópico.
Podíamos haber llegado directamente a este resultado observando que en función de la presión y el volumen
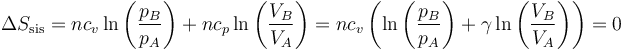
Vemos que la isentropía se deduce de la ley de Poisson y viceversa.





