Tubo con dos cámaras de gas
De Laplace
1 Enunciado
Se tiene una cámara cilíndrica horizontal de 20 cm de diámetro y 60 cm de longitud de paredes rígidas. En el punto medio del tubo se encuentra un émbolo (de espesor despreciable) que puede desplazarse, aunque inicialmente está fijado con pernos. En la cámara de la izquierda hay 4.0 g de H2 gaseoso y en la de la derecha 4.0 g de N2. Los dos gases y el ambiente que los rodea están a 25°C.
- Halle la fuerza que los gases producen sobre el émbolo cuando éste se encuentra en la posición central.
- Determine la posición final del émbolo una vez que se liberan los pernos, suponiendo que todas las superficies son diatermas
2 Fuerza
Sea 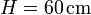 la longitud del tubo y
la longitud del tubo y
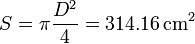
su sección. El volumen cada gas es el mismo, la mitad del del cilindro
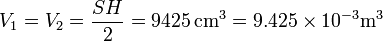
y también son iguales sus temperaturas
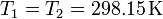
Sus presiones, sin embargo, son diferentes. Aunque en las dos cámaras se encuentra la misma masa de gas, el número de moles es diferente. Obtenemos la cantidad de moles dividiendo por el peso molecular. Para el hidrógeno
y para el nitrógeno
En estas fórmulas se podían haber usado como masas moleculares 2 g/mol y 28 g/mol, y el resultado sería bastante aproximado al correcto.
Esto nos da la presión del hidrógeno
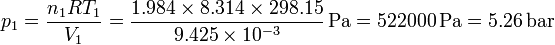
y la del nitrógeno
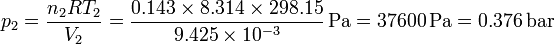
Vemos que la presión es mucho mayor en el lado del hidrógeno, por haber muchos más moles de este gas.





