Máximo aprovechamiento del calor
De Laplace
Contenido |
1 Enunciado
Suponga que se tiene un bloque de 10 kg de hierro (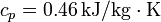 ) a una temperatura de 200°C y se quiere usar para caldear una gran habitación a una temperatura
) a una temperatura de 200°C y se quiere usar para caldear una gran habitación a una temperatura 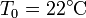 , estando el exterior a 5°C.
, estando el exterior a 5°C.
- Si se coloca el bloque directamente en la habitación, calcule el calor que libera al ambiente.
- Halle la variación de entropía del bloque y del universo en el caso anterior.
- El calor del bloque puede aprovecharse para producir algún trabajo. Para ello, suponga que cuando el bloque se encuentra a una temperatura T, y libera una cantidad de calor
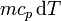 , dicho calor se hace pasar por una máquina reversible que opera entre la temperatura T y la del ambiente. Calcule el trabajo obtenible en este paso y la cantitad total de trabajo que se podría obtener.
, dicho calor se hace pasar por una máquina reversible que opera entre la temperatura T y la del ambiente. Calcule el trabajo obtenible en este paso y la cantitad total de trabajo que se podría obtener.
- Compruebe que el trabajo perdido es igual a T0ΔSu
- Si ese trabajo se aprovechara para hacer funcionar una bomba de calor reversible que operara entre el exterior y la habitación, ¿cuánto sería el calor total que se liberaría en la habitación?
2 Calor liberado directamente
Si calentamos la habitación simplemente depositando el bloque en la habitación, la cantidad de calor que libera es la correspondiente al descenso de temperatura desde su valor inicial, que llamaremos T1 a T0, la temperatura de la habitación (que, por ser de gran tamaño supondremos un baño térmico). Este calor es
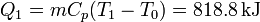
3 Variación de entropía
Existen dos cambios en la entropía, uno en el bloque de hierro, que al enfriarse ve reducida su entropía, y otro en la habitación que al recibir calor la ve incrementada.
3.1 Variación en el ambiente
La habitación recibe calor a una temperatura constante T0, por lo que su aumento de entropía es simplemente
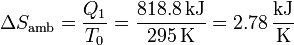
3.2 Variación en el bloque
La variación para el bloque la calculamos suponiendo un proceso reversible, consistente en que su temperatura va bajando gradualmente, siendo uniforme en el bloque en todo momento. En ese caso
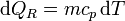

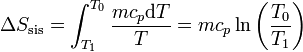
siendo su valor numérico
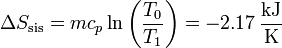
3.3 Variación total
Sumando los dos incrementos
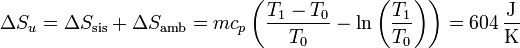
La variación neta es positiva, como corresponde a un proceso posible e irreversible.
4 Trabajo perdido
Parecería que colocar el bloque en la habitación es la forma más eficiente de calentar ésta, ya que todo el calor saliente va a parar a ella. Sin embargo, no lo es. Desde el mismo momento que hay producción de entropía y el proceso es irreversible, es claro que debe haber algún proceso más eficiente que sea reversible.
La causa de la irreversibilidad es la diferencia finita de temperaturas. El calor se derrama por la habitación como el agua que cae por una cascada. Pero al igual que en la cascada se puede colocar una central hidroeléctrica, entre la salida de calor del bloque y su llegada a la habitación se podría poner una máquina térmica reversible que aprovechara parte del calor para producir trabajo útil.
En un momento dado el bloque se encontrará a una temperatura T y cederá reversiblemente un calor − mcpdT (el signo porque la temperatura disminuye, dT es negativo, pero el calor cedido es positivo respecto de la máquina). Con ese calor la máquina hará un trabajo también diferencial
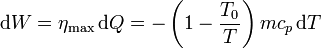
Integrando obtenemos el trabajo perdido, que podríamos haber aprovechado con esta máquina térmica

esto es, podríamos haber aprovechado el 21% del calor cedido.
5 Relación con la entropía
Es inmediato comprobar que el trabajo perdido es igual al incremento de entropía multiplicado por la temperatura ambiente
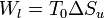
Por tanto, vemos que existe una asociación directa entre la producción de entropía y el trabajo aprovechable que podríamos haber sacado del sistema.
Esta ecuación es un caso particular de la relación
que nos dice que el trabajo producido en un proceso irreversible (en nuestro caso, ninguno) es igual al calor que podríamos producir reversiblemente (el máximo, en nuestro caso el que hemos calculado) menos que lo que se pierde producción de entropía (en nuestro caso, todo).
Cuando la temperatura del foco frío, en nuestro caso la habitación, es la del ambiente y el bloque se considera finalmente en el estado muerto, ese trabajo máximo que podría extraerse es la llamada exergía del sistema.
6 Calor extra aprovechable
Si extraemos el trabajo aprovechable, la cantidad de calor que el ladrillo mete directamente en la habitación se ve reducido. Pasa a ser
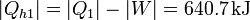
Parece entonces que estamos peor que antes, pues el bloque estaría calentando menos la habitación. No es así, porque ahora tenemos 178 kJ de trabajo a nuestra disposición para aprovechar como queramos.
Y la forma más eficiente es usarlo para hacer funcionar una boma de calor entre el exterior (a 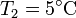 ) y la habitación. La cantidad máxima de calor que introducimos la da el coeficiente de desempeño de una bomba de calor reversible
) y la habitación. La cantidad máxima de calor que introducimos la da el coeficiente de desempeño de una bomba de calor reversible
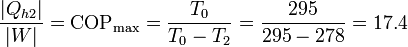
Esto quiere decir que podemos bombear al interior una cantidad de calor
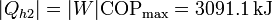
El calor total que introducimos es la suma del de desecho del bloque metálico más el que mete la bomba
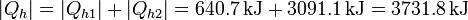
Esta cantidad es considerablemente superior a la que sacaríamos directamente del bloque
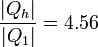
Este valor que hemos indicado es el máximo posible, ya que todos los procesos implicados son reversibles. Para este proceso doble (bloque que alimenta una máquina térmica reversible, que mueve una bomba de calor también reversible) la producción de entropía es 0 y no hay trabajo perdido.





