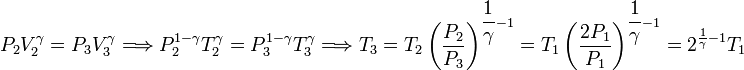Proceso isotermo y adiabático consecutivos
De Laplace
Contenido |
1 Enunciado
Se comprime un mol de aire en condiciones estándar mediante un proceso isotermo hasta reducir su volumen a la mitad, luego se expande adiabáticamente hasta recuperar su presión inicial. Ambos procesos son cuasiestáticos. Halle
- La temperatura final
- El trabajo total realizado por el gas
- El calor total absorbido por el gas
- La variación de energía interna
2 Solución
El gráfico representa los dos procesos a los que se somete el gas, primero una compresión isoterma y después una expansión adiabática. Analicemos cada uno de estos procesos
2.1 Compresión isoterma
Los datos que tenemos de este proceso son
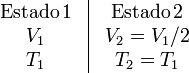
Al ser isotermo la variación de energía interna del gas es nula
ΔU12 = 0
El trabajo realizado es
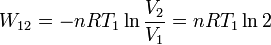
Y el calor absorbido es
Q12 = − W12 = nRT1ln2
2.2 Expansión adiabática
El proceso viene descrito por los parámetros
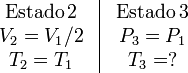
Podemos determinar P2 usando la ley de Boyle para relacionar los estados 1 y 2
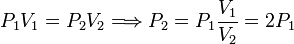
Y ahora usamos la ecuación de Poisson para relacionar los estados 2 y 3