Expansión lineal de un gas
De Laplace
Contenido |
1 Enunciado
Se tiene una cantidad fija de un gas ideal diatómico situada a una presión p0, volumen V0 y temperatura T0. Experimenta un proceso tal que la presión final es 2p0 y el volumen 2V0.
- En este proceso, ¿cómo varía la temperatura?
- Halle el incremento de la energía interna en este proceso
Supongamos que el proceso anterior ocurre de manera cuasiestática según la ley
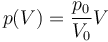
- ¿Cuánto trabajo se realiza sobre el gas en esta expansión cuasiestática?
- ¿Cuánto calor entra en el gas en la expansión cuasiestática?
2 Temperatura final
Puesto que la cantidad de gas es constante, podemos emplear la ley de los gases ideales en la forma
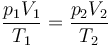
donde en este caso
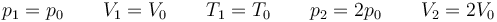
lo que nos da
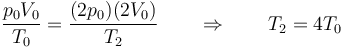
Vemos que en este proceso aumentan simultáneamente la presión, el volumen y la temperatura. Una expansión no significa necesariamente una reducción en la presión, ya que simultáneamente se puede estar calentando el gas y aumentando su presión y temperatura.
3 Variación de la energía interna
La energía interna de un gas ideal solo depende de la temperatura. Si la capacidad calorífica es constante, la energía interna se puede escribir
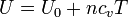
siendo su incremento
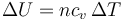
Podemos relacionar esto con los datos del problema observando que
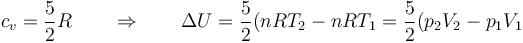
Sustituyendo las presiones y volúmenes
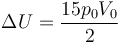
4 Trabajo realizado
En un proceso cuasistático puede calcularse el trabajo neto realizado sobre un sistema mediante la integral
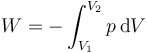
Para este caso en concreto
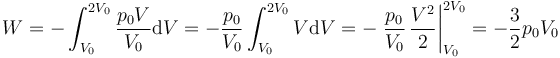
El trabajo es negativo pué al expandirse, realmente es el gas interior el que realiza trabajo sobre el ambiente.
5 Calor que entra en el gas
Una vez que tenemos el trabajo y la variación de la energía interna, el cálculo del calor que entra es inmediato, por aplicación del principio de la termodinámica
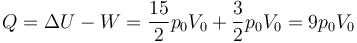
Este calor que entra es responsable tanto del aumento de la energía interna como del trabajo realizado por el gas sobre el ambiente.





