Entropía
De Laplace
(→Definición de entropía) |
(→Definición de entropía) |
||
| Línea 22: | Línea 22: | ||
==Definición de entropía== | ==Definición de entropía== | ||
| + | ===Variación de entropía=== | ||
Para un ciclo reversible, la desigualdad de Clausius se transforma en una igualdad. | Para un ciclo reversible, la desigualdad de Clausius se transforma en una igualdad. | ||
| Línea 46: | Línea 47: | ||
<center><math>\mathrm{d}S = \frac{\mathrm{d}Q_R}{T}</math></center> | <center><math>\mathrm{d}S = \frac{\mathrm{d}Q_R}{T}</math></center> | ||
| - | + | Dicho con palabras: el incremento diferencial de entropía entre dos estados vecinos es igual la cantidad de calor que entra '''reversiblemente''' entre dichos estados dividida por la temperatura a la que se intercambia el calor. Puesto que estamos hablando de procesos reversibles no es necesario distinguir entre la temperatura del ambiente T y la del sistema T', ya que en un proceso reversible ambas deben diferenciarse como mucho en una cantidad infinitesimal. | |
| + | |||
| + | ===Entropía absoluta=== | ||
| + | La definición anterior sólo nos da la diferencia de entropía entre dos estados, no su valor absoluto. | ||
==Principio del aumento de entropía== | ==Principio del aumento de entropía== | ||
Revisión de 08:07 16 may 2009
Contenido |
1 Introducción
2 Desigualdad de Clausius
La desigualdad de Clausius establece que, para todo proceso cíclico
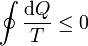
donde cada uno de los símbolos posee la siguiente interpretación
-
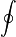
- La integral con el circulito se denomina “integral cerrada” y quiere decir que la suma se efectúa sobre una curva que se cierra sobre sí misma
- dQ
- representa la cantidad de calor diferencial que entra en el sistema desde un foco situado a la temperatura T. A lo largo de un ciclo habrá ocasiones en que su valor sea positivo y veces en que será negativo, según el sistema absorba o ceda calor.
- T
- es la temperatura del foco que cede el calor. No es la temperatura del sistema. Es más, para empezar la temperatura del sistema probablemente ni estará definida. En algunos puntos tendrá un valor y en otros será distinto. En el caso de que sí tenga un valor definido, T', este valor será menor que el exterior cuando el calor entra (ya que si no, no entraría), y será mayor que el exterior cuando el calor sale. Solo en un proceso reversible T' se diferenciará una cantidad infinitesimal de T (ya que si no, no sería reversible).
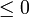
- La desigualdad de Clausius no nos dice cuanto vale la integral, en general. Solo nos informa de sus signo. Pero al hacerlo nos proporciona un criterio para clasificar los posibles procesos:
- Si la integral es negativa: el proceso es irreversible.
- Si la integral es nula: el proceso es reversible.
- Si la integral es positiva: el proceso es imposible.
3 Definición de entropía
3.1 Variación de entropía
Para un ciclo reversible, la desigualdad de Clausius se transforma en una igualdad.
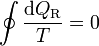 (ciclo reversible)
(ciclo reversible)Consideremos ahora un ciclo reversible que pasa por dos estados A y B. Podemos suponer este ciclo como formado por dos caminos C y C' que van de A a B, siendo uno de ellos (C') recorrido de B a A. Para este ciclo la igualdad se convierte en
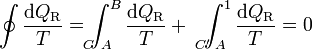
y, despejando

Ahora bien, por ser los caminos reversibles, la integral de B a A por C' es igual a la integral de A a B por el mismo camino C', cambiada de signo. Físicamente, esto quiere decir que si vamos de B a A por C' y en un cierto paso entra en el sistema una cantidad de calor dQR, si recorremos el camino en sentido contrario, cuando lleguemos al mismo sitio la misma cantidad de calor saldrá del sistema (es decir, que en el camino inverso entra − dQR). Por tanto
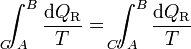
Puesto que este resultado puede extenderse a cualquier otro camino reversible que conecte A con B, concluimos que el valor de la integral es independiente del camino y por tanto solo depende de los estados inicial y final. Por ello, su valor es igual a la diferencia de una cierta función de estado que denominamos entropía
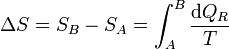
o, en forma diferencial
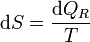
Dicho con palabras: el incremento diferencial de entropía entre dos estados vecinos es igual la cantidad de calor que entra reversiblemente entre dichos estados dividida por la temperatura a la que se intercambia el calor. Puesto que estamos hablando de procesos reversibles no es necesario distinguir entre la temperatura del ambiente T y la del sistema T', ya que en un proceso reversible ambas deben diferenciarse como mucho en una cantidad infinitesimal.
3.2 Entropía absoluta
La definición anterior sólo nos da la diferencia de entropía entre dos estados, no su valor absoluto.
4 Principio del aumento de entropía
4.1 Ciclo parcialmente irreversible
Supongamos ahora un ciclo irreversible formado por un camino irreversible que lleva del estado 1 al 2 y vuelve por un camino reversible. En este caso tenemos la desigualdad
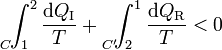
que equivale a decir que la integral por el camino reversible es mayor que por el irreversible
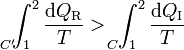
Pero la integral por el camino reversible es justamente la diferencia entre la entropía inicial y la final. Por tanto
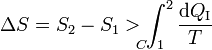
Podemos transformar esta desigualdad en una igualdad introduciendo la producción de entropía Sgen
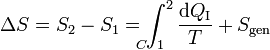
Por tanto la desigualdad de Clausius equivale a decir que la producción de entropía en un sistema es siempre positiva (en un proceso irreversible) o nula (en uno reversible). Nunca negativa.
4.2 Principio del aumento de entropía
En el caso particular de un sistema aislado, ningún calor entra o sale del sistema, dQ = 0 y por tanto
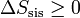 (sistema aislado)
(sistema aislado)esto es, para un sistema aislado la entropía es una función creciente en todo proceso real. Sólo si el proceso es reversible la entropía permanece constante.
Si consideramos el “universo” como el conjunto del sistema más la parte del ambiente con la que intercambia calor o trabajo, podemos tratar al universo como un sistema aislado, con lo que obtenemos el principio del aumento de entropía:
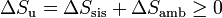
esto es, en todo proceso real la entropía aumenta (si el proceso es irreversible) o permanece estacionaria (si es reversible), pero nunca disminuye.
Obsérvese que en un proceso real es posible que la entropía del sistema disminuya (es lo que ocurre normalmente si se enfría), pero esa disminución debe ser compensada por un aumento en el ambiente, que supere con creces dicha disminución.





