Entropía
De Laplace
(→Definición de entropía) |
(→Principio del aumento de entropía) |
||
| Línea 21: | Línea 21: | ||
==Principio del aumento de entropía== | ==Principio del aumento de entropía== | ||
| + | ===Ciclo parcialmente irreversible=== | ||
| + | Supongamos ahora un ciclo irreversible formado por un camino irreversible que lleva del estado 1 al 2 y vuelve por un camino reversible. En este caso tenemos la desigualdad | ||
| + | |||
| + | <center><math>\int_{1\!\!\!\!\!\!\!\!\!\!\!\!C}^2\frac{\mathrm{d}Q_\mathrm{I}}{T}+\ \ \int_{2\!\!\!\!\!\!\!\!\!\!\!\!\!C'}^1\frac{\mathrm{d}Q_\mathrm{R}}{T}<0</math></center> | ||
| + | |||
| + | que equivale a decir que la integral por el camino reversible es mayor que por el irreversible | ||
| + | |||
| + | <center><math>\int_{1\!\!\!\!\!\!\!\!\!\!\!\!\!C'}^2\frac{\mathrm{d}Q_\mathrm{R}}{T} >\ \int_{1\!\!\!\!\!\!\!\!\!\!\!\!C}^2\frac{\mathrm{d}Q_\mathrm{I}}{T}</math></center> | ||
| + | |||
| + | Pero la integral por el camino reversible es justamente la diferencia entre la entropía inicial y la final. Por tanto | ||
| + | |||
| + | <center><math>\Delta S = S_2 -S_1 > \int_{1\!\!\!\!\!\!\!\!\!\!\!\!C}^2\frac{\mathrm{d}Q_\mathrm{I}}{T}</math></center> | ||
| + | |||
| + | Podemos transformar esta desigualdad en una igualdad introduciendo la ''producción de entropía'' <math>S_\mathrm{gen}</math> | ||
| + | |||
| + | <center><math>\Delta S = S_2 -S_1 = \int_{1\!\!\!\!\!\!\!\!\!\!\!\!C}^2\frac{\mathrm{d}Q_\mathrm{I}}{T}+ S_\mathrm{gen}</math></center> | ||
| + | |||
| + | Por tanto la desigualdad de Clausius equivale a decir que la producción de entropía en un sistema es siempre positiva (en un proceso irreversible) o nula (en uno reversible). Nunca negativa. | ||
| + | |||
| + | ===Principio del aumento de entropía=== | ||
| + | En el caso particular de un sistema aislado, ningún calor entra o sale del sistema, <math>\mathrm{d}Q=0</math> y por tanto | ||
| + | |||
| + | <center><math>\Delta S_\mathrm{sis} \geq 0</math>{{qquad}}{{qquad}}(sistema aislado)</center> | ||
| + | |||
| + | esto es, para un sistema aislado la entropía es una función creciente en todo proceso real. Sólo si el proceso es reversible la entropía permanece constante. | ||
| + | |||
| + | Si consideramos el “universo” como el conjunto del sistema más la parte del ambiente con la que intercambia calor o trabajo, podemos tratar al universo como un sistema aislado, con lo que obtenemos el ''principio del aumento de entropía'': | ||
| + | |||
| + | <center><math>\Delta S_\mathrm{u}=\Delta S_\mathrm{sis}+\Delta S_\mathrm{amb}\geq 0</math></center> | ||
| + | |||
| + | esto es, en todo proceso real la entropía aumenta (si el proceso es irreversible) o permanece estacionaria (si es reversible), pero nunca disminuye. | ||
| + | |||
| + | Obsérvese que en un proceso real es posible que la entropía del sistema disminuya (es lo que ocurre normalmente si se enfría), pero esa disminución debe ser compensada por un aumento en el ambiente, que supere con creces dicha disminución. | ||
| + | |||
==Relación con otros enunciados del segundo principio== | ==Relación con otros enunciados del segundo principio== | ||
==Entropía y trabajo perdido== | ==Entropía y trabajo perdido== | ||
Revisión de 18:39 15 may 2009
Contenido |
1 Introducción
2 Desigualdad de Clausius
3 Definición de entropía
Para un ciclo reversible, la desigualdad se transforma en una igualdad. Si tomamos un ciclo que vaya de un estado 1 a un estado 2, por un cierto camino reversible C, o volvemos por otro también reversible C', la igualdad se convierte en
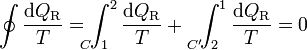
Por ser los caminos reversibles, la integral de 2 a 1 por C' es igual a la integral de 1 a 2 por el mismo camino C', cambiada de signo. Esto implica
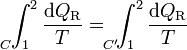
Puesto que esto es cierto para cualquier otro camino reversible que conecte 1 con 2, concluimos que el valor de la integral es independiente del camino y por tanto solo depende de los estados inicial y final. Por tanto, su valor es igual a la diferencia de una cierta función de estado que denominamos entropía
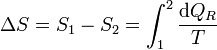
o, en forma diferencial
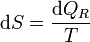
Obsérvese que esta definición sólo nos da el incremento de entropía entre dos estados, no el valor absoluto en cada uno de ellos. Por ello, es preciso definir un estado de referencia a partir del cual se mide la entropía.
4 Principio del aumento de entropía
4.1 Ciclo parcialmente irreversible
Supongamos ahora un ciclo irreversible formado por un camino irreversible que lleva del estado 1 al 2 y vuelve por un camino reversible. En este caso tenemos la desigualdad
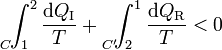
que equivale a decir que la integral por el camino reversible es mayor que por el irreversible
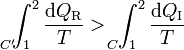
Pero la integral por el camino reversible es justamente la diferencia entre la entropía inicial y la final. Por tanto
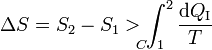
Podemos transformar esta desigualdad en una igualdad introduciendo la producción de entropía Sgen
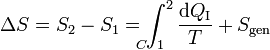
Por tanto la desigualdad de Clausius equivale a decir que la producción de entropía en un sistema es siempre positiva (en un proceso irreversible) o nula (en uno reversible). Nunca negativa.
4.2 Principio del aumento de entropía
En el caso particular de un sistema aislado, ningún calor entra o sale del sistema, dQ = 0 y por tanto
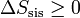 (sistema aislado)
(sistema aislado)esto es, para un sistema aislado la entropía es una función creciente en todo proceso real. Sólo si el proceso es reversible la entropía permanece constante.
Si consideramos el “universo” como el conjunto del sistema más la parte del ambiente con la que intercambia calor o trabajo, podemos tratar al universo como un sistema aislado, con lo que obtenemos el principio del aumento de entropía:
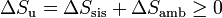
esto es, en todo proceso real la entropía aumenta (si el proceso es irreversible) o permanece estacionaria (si es reversible), pero nunca disminuye.
Obsérvese que en un proceso real es posible que la entropía del sistema disminuya (es lo que ocurre normalmente si se enfría), pero esa disminución debe ser compensada por un aumento en el ambiente, que supere con creces dicha disminución.





