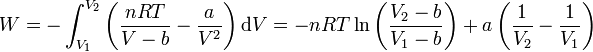Ecuación de Van der Waals
De Laplace
(Diferencias entre revisiones)
(Nueva página: __TOC__ ==Enunciado== El comportamiento del gas butano se ajusta, dentro de ciertos límites, a la ecuación de estado de Van der Waals <center><math>\left(P +\frac{a}{V^2}\right)(V-...) |
(→Trabajo) |
||
| Línea 19: | Línea 19: | ||
y sustituyendo e integrando | y sustituyendo e integrando | ||
| - | <center><math>W = - \int_{V_1}^{V_2}\left(\frac{nRT}{V-b}-\frac{a}{V^2}\right)\mathrm{d}V = -nRT\ln\left(\frac{V_2-b}{ | + | <center><math>W = - \int_{V_1}^{V_2}\left(\frac{nRT}{V-b}-\frac{a}{V^2}\right)\mathrm{d}V = -nRT\ln\left(\frac{V_2-b}{V_1-b}\right)+a\left(\frac{1}{V_2}-\frac{1}{V_1}\right)</math></center> |
==Comparación con el gas ideal== | ==Comparación con el gas ideal== | ||
Revisión de 10:04 28 abr 2009
Contenido |
1 Enunciado
El comportamiento del gas butano se ajusta, dentro de ciertos límites, a la ecuación de estado de Van der Waals

siendo en este caso a = 14.5 atm·l² y b = 0.122 l. Calcule el trabajo realizado por un mol de gas butano, considerándolo como un gas de Van der Waals, al expansionarse cuasiestáticamente desde 2 l hasta 3 l a la temperatura constante de t = 27°C. Compare con el resultado que daría la ecuación de los gases ideales.
2 Trabajo
Por tratarse de un proceso cuasiestático, podemos calcular el trabajo realizado sobre el gas mediante la integral
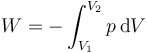
Despejando la presión de la ecuación de Van der Waals
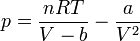
y sustituyendo e integrando