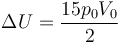Expansión lineal de un gas
De Laplace
(Página creada con '==Enunciado== Se tiene una cantidad fija de un gas ideal diatómico situada a una presión <math>p_0</math>, volumen <math>V_0</math> y temperatura <math>T_0</math>. Experimenta…') |
|||
| Línea 15: | Línea 15: | ||
==Temperatura final== | ==Temperatura final== | ||
| + | Puesto que la cantidad de gas es constante, podemos emplear la ley de los gases ideales en la forma | ||
| + | |||
| + | <center><math>\frac{p_1V_1}{T_1}=\frac{p_2V_2}{T_2}</math></center> | ||
| + | |||
| + | donde en este caso | ||
| + | |||
| + | <center><math>p_1=p_0\qquad V_1=V_0\qquad T_1 = T_0\qquad p_2=2p_0\qquad V_2=2V_0</math></center> | ||
| + | |||
| + | lo que nos da | ||
| + | |||
| + | <center><math>\frac{p_0V_0}{T_0}=\frac{(2p_0)(2V_0)}{T_2}\qquad\Rightarrow\qquad T_2 = 4T_0</math></center> | ||
| + | |||
| + | Vemos que en este proceso aumentan simultáneamente la presión, el volumen y la temperatura. Una expansión no significa necesariamente una reducción en la presión, ya que simultáneamente se puede estar calentando el gas y aumentando su presión y temperatura. | ||
==Variación de la energía interna== | ==Variación de la energía interna== | ||
| + | La energía interna de un gas ideal solo depende de la temperatura. Si la capacidad calorífica es constante, la energía interna se puede escribir | ||
| + | |||
| + | <center><math>U = U_0+n c_v T\,</math></center> | ||
| + | |||
| + | siendo su incremento | ||
| + | |||
| + | <center><math>\Delta U = n c_v\,\Delta T</math></center> | ||
| + | |||
| + | Podemos relacionar esto con los datos del problema observando que | ||
| + | |||
| + | <center><math>c_v = \frac{5}{2}R\qquad\Rightarrow\qquad \Delta U = \frac{5}{2}(nRT_2-nRT_1=\frac{5}{2}(p_2V_2-p_1V_1</math></center> | ||
| + | |||
| + | Sustituyendo las presiones y volúmenes | ||
| + | |||
| + | <center><math>\Delta U = \frac{15p_0V_0}{2}</math></center> | ||
| + | |||
==Trabajo realizado== | ==Trabajo realizado== | ||
==Calor que entra en el gas== | ==Calor que entra en el gas== | ||
[[Categoría:Problemas del primer principio de la termodinámica (GIE)]] | [[Categoría:Problemas del primer principio de la termodinámica (GIE)]] | ||
Revisión de 00:31 22 feb 2013
Contenido |
1 Enunciado
Se tiene una cantidad fija de un gas ideal diatómico situada a una presión p0, volumen V0 y temperatura T0. Experimenta un proceso tal que la presión final es 2p0 y el volumen 2V0.
- En este proceso, ¿cómo varía la temperatura?
- Halle el incremento de la energía interna en este proceso
Supongamos que el proceso anterior ocurre de manera cuasiestática según la ley
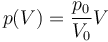
- ¿Cuánto trabajo se realiza sobre el gas en esta expansión cuasiestática?
- ¿Cuánto calor entra en el gas en la expansión cuasiestática?
2 Temperatura final
Puesto que la cantidad de gas es constante, podemos emplear la ley de los gases ideales en la forma
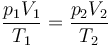
donde en este caso
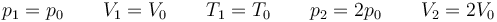
lo que nos da
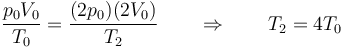
Vemos que en este proceso aumentan simultáneamente la presión, el volumen y la temperatura. Una expansión no significa necesariamente una reducción en la presión, ya que simultáneamente se puede estar calentando el gas y aumentando su presión y temperatura.
3 Variación de la energía interna
La energía interna de un gas ideal solo depende de la temperatura. Si la capacidad calorífica es constante, la energía interna se puede escribir
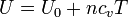
siendo su incremento
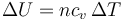
Podemos relacionar esto con los datos del problema observando que
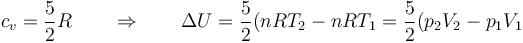
Sustituyendo las presiones y volúmenes