Refrigeración de una habitación
De Laplace
(→Calor extraído) |
|||
| Línea 37: | Línea 37: | ||
<center><math>Q_\mathrm{out}=-Q = 6470\,\mathrm{kJ}</math></center> | <center><math>Q_\mathrm{out}=-Q = 6470\,\mathrm{kJ}</math></center> | ||
| - | + | ||
| + | En una situación real, se trataría de un sistema abierto, con entrada o salida de aire, de manera que tanto la presión como el volumen permanecen constantes, pero hacemos un modelo más sencillo. | ||
| + | |||
==Variación de entropía== | ==Variación de entropía== | ||
==Coeficiente de desempeño== | ==Coeficiente de desempeño== | ||
==Calor de desecho== | ==Calor de desecho== | ||
[[Categoría:Problemas de máquinas térmicas (GIE)]] | [[Categoría:Problemas de máquinas térmicas (GIE)]] | ||
Revisión de 18:49 8 sep 2012
Contenido |
1 Enunciado
En una habitación de 15 m×10 m×3 m hay aire (equivalente a un gas ideal diatómico de peso molecular 28.97 g/mol) a 40 °C (que también es la temperatura exterior) y 100 kPa.
- ¿Cuál es la masa de aire contenida en la habitación?
- Con un aparato de aire acondicionado se baja la temperatura de la habitación (con las ventanas y puertas cerradas) hasta 22 °C. ¿Cuánto calor sale de la habitación?
- ¿Cuánto varía la entropía del aire de la habitación en el proceso anterior?
- ¿Cuánto es el coeficiente de desempeño (COPR) máximo que puede tener un aparato de aire acondicionado que funcione entre las dos temperaturas indicadas?
- Si el COPR del aparato empleado es 3.0, ¿cuánto calor de desecho se expulsa al exterior?
2 Masa de aire
Para hallar la masa de aire aplicamos la ley de los gases ideales. Primero calculamos el volumen y la temperatura absoluta

luego el número de moles
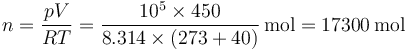
y, conociendo el peso molecular aparente, la masa de aire
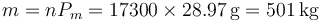
3 Calor extraído
Puesto que las puertas y ventanas están cerradas, se trata de un proceso a volumen constante, por el que el calor que entra en el sistema es
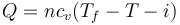
siendo
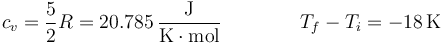
y el calor
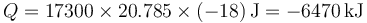
puesto que se nos pide el calor que sale de la habitación

En una situación real, se trataría de un sistema abierto, con entrada o salida de aire, de manera que tanto la presión como el volumen permanecen constantes, pero hacemos un modelo más sencillo.





