Trabajo en termodinámica (GIE)
De Laplace
(→Trabajo integral) |
(→Trabajo diferencial) |
||
| Línea 23: | Línea 23: | ||
<center><math>|\delta W| = \left|F\,\mathrm{d}x\right| = \left|p_\mathrm{ext}S\frac{\mathrm{d}V}{S}\right| = \left|p_\mathrm{ext}\mathrm{d}V\right|</math></center> | <center><math>|\delta W| = \left|F\,\mathrm{d}x\right| = \left|p_\mathrm{ext}S\frac{\mathrm{d}V}{S}\right| = \left|p_\mathrm{ext}\mathrm{d}V\right|</math></center> | ||
| + | |||
| + | De aquí obtenemos una relación entre unidades. Si empleamos el SI para cada una de las magnitudes se cumple | ||
| + | |||
| + | <center><math>1\,\mathrm{J} = 1\,\mathrm{Pa}\cdot\mathrm{m}^3</math></center> | ||
| + | |||
| + | De esta relación se ve la ventaja de usar pascales como unidad de presión, ya que si multiplicamos la presión por el cambio de volumen, medido también en el SI, el resultado ya está directamente en julios. En cambio, si se mide la presión en atmósferas o milímetros de mercurio, el volumen en litros o el trabajo en calorías, es preciso introducir factores de conversión para completar los cálculos. | ||
===Convenio de signos=== | ===Convenio de signos=== | ||
Revisión de 10:12 6 mar 2012
Contenido[ocultar] |
1 Trabajo
(Sección 2-4 de Çengel & Boles (6ª Ed.) )
1.1 Trabajo diferencial
El concepto de trabajo en termodinámica es una generalización de la correspondiente definición de trabajo en mecánica. Cuando tenemos una fuerza F actuando sobre una partícula, de forma que ésta se desplaza una cantidad dx en la dirección de la fuerza, el trabajo realizado es igual a
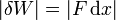
Si tenemos tres componentes de la fuerza y un desplazamiento arbitrario, el trabajo diferencial es la suma del realizado por cada una de las componentes
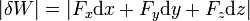
En esta expresión se usa “δ” (delta) para el trabajo diferencial en lugar de “d” para indicar que el trabajo no es la variación de ninguna cantidad, no es “el trabajo ha aumentado en δW”, sino “se ha realizado un trabajo δW” Para un mismo desplazamiento puede haber muchos valores del trabajo posibles, dependiendo de la fuerza que se haya aplicado.
Este concepto se extiende de forma inmediata al trabajo sobre un fluido (líquido o gas). Supongamos que tenemos un gas limitado por una frontera móvil, como un émbolo, sobre la cual se aplica una presión pext. La fuerza ejercida sobre el émbolo será
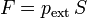
mientras que la variación en el volumen del fluido es proporcional al desplazamiento del pistón
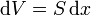
Esto nos da el valor absoluto del trabajo diferencial

De aquí obtenemos una relación entre unidades. Si empleamos el SI para cada una de las magnitudes se cumple
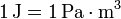
De esta relación se ve la ventaja de usar pascales como unidad de presión, ya que si multiplicamos la presión por el cambio de volumen, medido también en el SI, el resultado ya está directamente en julios. En cambio, si se mide la presión en atmósferas o milímetros de mercurio, el volumen en litros o el trabajo en calorías, es preciso introducir factores de conversión para completar los cálculos.
1.2 Convenio de signos
En las expresiones anteriores se ha empleado el valor absoluto porque queda por definir el criterio de signos para el trabajo. Por desgracia, no existe unanimidad de criterios y es importante, al consultar una referencia, el tener claro qué criterio se usa.
Aquí seguiremos el criterio de la IUPAC según el cual
- Si el trabajo se realiza por el entorno sobre el sistema, es positivo
- Si el trabajo es realizado por el sistema sobre el entorno, es negativo
Físicamente veremos, al enunciar el primer principio de la termodinámica, que este criterio se puede enunciar como que aquél trabajo que aumenta la energía interna es positivo y el que la reduce es negativo (la elección opuesta es bastante frecuente en los libros de texto, ya que se origina en el estudio de las máquinas térmicas, en las que interesa que el sistema –la máquina– realice trabajo y por tanto se considera positivo al realizado por el sistema).
Con este criterio, podemos asignarle el signo correcto a las expresiones anteriores. Consideremos un volumen de gas que se comprime por causa de una presión externa. En este caso se hace trabajo sobre el sistema, por lo que debe resultar un valor positivo. Por otro lado, en este proceso el diferencial de volumen es negativo (ya que se reduce), por lo que debe ser
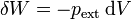
Esta misma fórmula vale para el caso de la expansión, para el cual dV > 0 y δW < 0.
Una forma de evitar los problemas que da la elección de un criterio consiste en evitar elegirlo, simplemente hablando de dos tipos de trabajo
- Win, el trabajo realizado sobre el sistema.
- Wout, el trabajo realizado por el sistema.
Si al analizar un proceso sabemos de antemano cuándo se realiza trabajo o cuándo se recibe, puede denominarse Win y Wout, suponiendo que ambos son positivos (aunque no hay problema alguno en que sean negativos, simplemente significa que va en sentido opuesto al que habíamos supuesto). Con esta notación el trabajo neto que entra en el sistema es
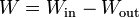
1.3 Trabajo en un proceso
Cuando tenemos un proceso en un sistema que lo lleva del estado A al estado B, el trabajo neto realizado será la suma de los trabajos diferenciales
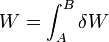
En el caso particular de un trabajo de compresión sobre un fluido
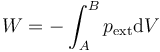
Esta expresión no puede representarse en un diagrama pV, ni es el área bajo ninguna curva en dicho diagrama. Recordemos que en un diagrama pV solo se representan estados de equilibrio y las coordenadas son los valores de las variables de estado (presión y volumen, por ejemplo) del sistema. En la expresión del trabajo aparece la presión externa, que puede o no coincidir con la interna (si es que ésta existe).
El concepto de trabajo es aplicable tanto a procesos cuasiestáticos como a cualquier otro, por lo que no hay que suponer que el sistema se encuentra en equilibrio cuando se realiza trabajo sobre él. De hecho, lo más habitual es que no este en equilibrio. Consideremos el proceso descrito en el problema “Trabajo en una compresión isoterma por un peso”. En este sistema, sobre un cilindro con pistón se aplica bruscamente un peso extra, de forma que la presión externa aplicada aumenta de p1 = patm a p2 = patm + mg / S. El resultado es que el pistón baja y el gas se comprime. Se alcanza de nuevo el equilibrio cuando la presión interior iguala a la nueva presión exterior y la temperatura iguala a la del ambiente.
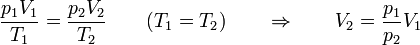
Este proceso es claramente no de equilibrio. Un golpe brusco provoca turbulencias en el gas, hace que la presión varíe de un punto a otro (lo que se manifiesta como sonido) y es necesario esperar un tiempo hasta que se vuelva a alcanzar el equilibrio. Podemos, no obstante, hallar el trabajo realizado sobre el gas, al ser la presión externa constante
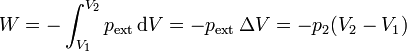
El resultado final se puede relacionar con las variables de estado del sistema, sabiendo que la presión interna final iguala a la externa.
1.4 Otras formas de trabajo
2 Tipos de trabajo
2.1 Sobre un gas ideal
Sección 4-1 de Çengel & Boles. ¡Ojo al criterio de signos!
2.2 Otros tipos
Las secciones 2-4 y 2.5 incluyen los tipos de trabajo más usuales, de los que solo consideramos el caso eléctrico y el de una fuerza F.





