Diagrama T-S
De Laplace
(→Procesos isócoros) |
(→Ciclos termodinámicos) |
||
| Línea 75: | Línea 75: | ||
==Ciclos termodinámicos== | ==Ciclos termodinámicos== | ||
| + | Combinando los procesos anteriores pueden trazarse procesos cíclicos en un diagrama TS. En todos los casos, el área encerrada por el ciclo, en valor absoluto, será el calor neto absorbido o cedido por el sistema que, por el Primer Principio de la termodinámica será igual al trabajo realizado por o sobre el sistema. | ||
| + | |||
| + | El caso más sencillo es el del ciclo de Carnot que ya hemos descrito anteriormente. | ||
| + | |||
| + | Para un sistema de gases ideales podemos analizar otros procesos cíclicos de aplicación práctica, como el ciclo Otto (de los motores de explosión) el Diesel (usado en los motores diésel) y el Brayton (empleado en las turbinas de los aviones). | ||
===Ciclo Otto=== | ===Ciclo Otto=== | ||
===Ciclo Diesel=== | ===Ciclo Diesel=== | ||
| - | ===Ciclo | + | ===Ciclo Brayton=== |
[[Categoría:Segundo Principio]] | [[Categoría:Segundo Principio]] | ||
Revisión de 18:01 1 jun 2009
Contenido |
1 Definición
Al definirse la entropía como una función de estado de un sistema, se hace posible describir el estado de dicho sistema, así como los procesos reversibles que en él ocurren, a través de un diagrama en el cual se representa la temperatura del sistema frente a su entropía.
Este es el llamado diagrama T-S en el cual se sitúa la entropía en el eje de abscisas y la temperatura en el de ordenadas. A menudo, en lugar de la entropía, como propiedad extensiva, se emplea la entropía específica (por unidad de masa o por mol) como variable en el eje de abscisas.
Este diagrama es análogo al diagrama PV para un gas ideal, con una diferencia esencial: mientras que un diagrama PV es específico para sistemas mecánicos y no puede aplicarse a otros sistemas termodinámicos, como un paramagnético (para el cual las variables son el campo magnético y la imanación), el diagrama TS posee validez universal, ya que se basa en dos propiedades fundamentales, la temperatura, establecida mediante el Principio Cero de la Termodinámica, y la entropía, definida a partir del Segundo Principio. Por ello, un ciclo de Carnot se representa de la misma forma en un diagrama TS, indpendientemente de que se trate de un gas ideal, un ciclo de agua y vapor, una sustancia paramagnética o cualquier otra.
No obstante, cuando se trata de un proceso específico en un sistema concreto (por ejemplo, un enfriamiento a presión constante en un gas ideal), la curva resultante en el diagrama TS será característica de dicho sistema y no aplicable a otros diferentes.
2 Procesos isotermos
Un proceso isotermo reversible mantiene, por definición, constante la temperatura del sistema. Puesto que en el diagrama TS la temperatura corresponde al eje de ordenadas, un proceso isotermo se representará como una línea y = cte, esto es, como un segmento horizontal.
3 Procesos adiabáticos
Un proceso adiabático es aquél en que el sistema no intercambia calor con el ambiente. Si además el proceso es reversible tenemos que
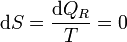

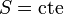
Es decir, un proceso adiabático reversible es siempre isentrópico. Puesto que la entropía se mide en el eje de abscisas en un diagrama TS, un proceso adiabático reversible corresponde a un segmento vertical. Estará orientado hacia arriba si el sistema se está calentando y hacia abajo si se está enfriando.
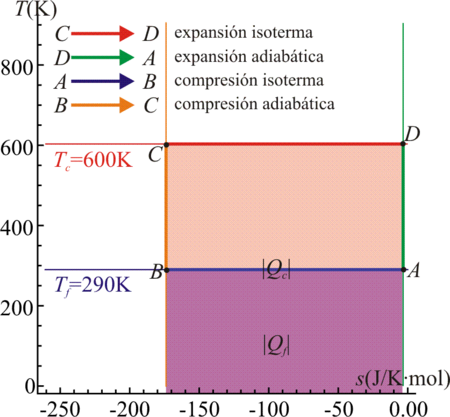
4 Ciclo de Carnot
Los dos procesos anteriores son independientes del sistema al que se apliquen. Por ello, un proceso compuesto de tramos isotermos y tramos adiabáticos se representará de la misma forma sea cual sea el sistema.
En particular, un ciclo de Carnot, formado por dos procesos isotermos y dos adiabáticos, presenta una representación especialmente sencilla.
El ciclo se compone de cuatro pasos:- C→D Absorción de calor Qc en un proceso isotermo a temperatura Tc, que corresponde a un segmento horizontal hacia la derecha.
- D→A Enfriamiento adiabático hasta la temperatura del foco frío, Tf, representable por un segmento vertical hacia abajo.
- A→B Cesión de calor | Qf | al foco frío a temperatura Tf, que corresponde a un segmento horizontal hacia la izquierda.
- B→C Calentamiento adiabático desde la temperatura del foco frío, Tf a la temperatura del foco caliente, Tc. De nuevo obtenemos un segmento vertical, ahora hacia arriba.
El resultado completo es un rectángulo recorrido en sentido horario.
En este diagrama el calor absorbido Qc es el área del rectángulo delimitado por el lado superior del ciclo y el eje de abscisas, mientras que el calor cedido | Qf | es el área del rectángulo definido por el lado inferior del ciclo y el eje de abscisas. El calor neto, | Qc | − | Qf | , que entra en el sistema es el área del rectángulo delimitado por el ciclo. Por el Primer Principio, este área equivale al trabajo neto efectuado por el sistema, | W | .
Si en vez de una máquina de Carnot tenemos un refrigerador de Carnot, la figura es exactamente la misma, solo que se recorren en sentido opuesto.
5 Caso de un gas ideal
5.1 Procesos isóbaros
En el caso particular de un gas ideal, podemos trazar las curvas correspondientes a procesos a presión y a volumen constante, puesto que disponemos de expresiones explícitas para la entropía de un gas ideal.
En términos de la temperatura y la presión, la entropía de un gas ideal es igual a
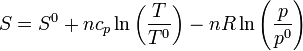
siendo T0, p0 y S0 la temperatura, presión y entropía de un cierto estado de referencia.
Si en vez de la entropía total consideramos la específica, por mol, la ecuación anterior nos queda
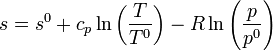
Despejando de aquí la temperatura
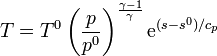
ya que
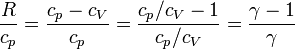
La ecuación anterior nos dice que en un diagrama TS un proceso a presión constante se representa por una curva exponencial creciente de la temperatura como función de la entropía.
5.2 Procesos isócoros
De manera análoga podemos representar los procesos a volumen constante. La entropía por mol de un gas ideal es, en función de la temperatura y el volumen molar v = V / n
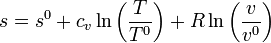
Despejando la temperatura
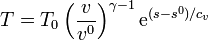
Vemos que las curvas isócoras son también exponenciales pero con un factor de crecimiento diferente. Puesto que cv < cp esto quiere decir que las isócoras poseen una pendiente mayor que las isóbaras.
6 Ciclos termodinámicos
Combinando los procesos anteriores pueden trazarse procesos cíclicos en un diagrama TS. En todos los casos, el área encerrada por el ciclo, en valor absoluto, será el calor neto absorbido o cedido por el sistema que, por el Primer Principio de la termodinámica será igual al trabajo realizado por o sobre el sistema.
El caso más sencillo es el del ciclo de Carnot que ya hemos descrito anteriormente.
Para un sistema de gases ideales podemos analizar otros procesos cíclicos de aplicación práctica, como el ciclo Otto (de los motores de explosión) el Diesel (usado en los motores diésel) y el Brayton (empleado en las turbinas de los aviones).